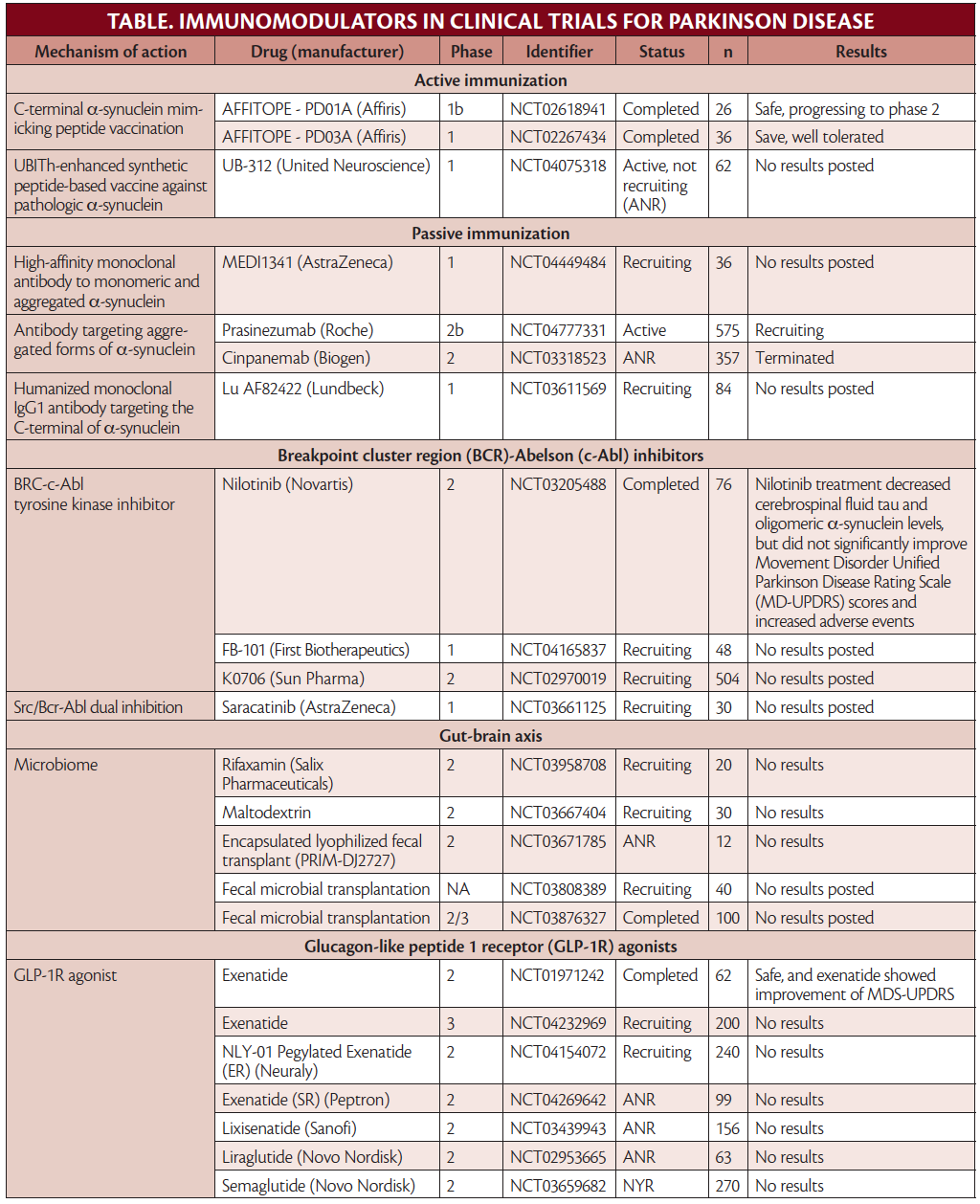
Vários imunomoduladores estão sendo avaliados para o potencial tratamento da doença de Parkinson.
22 SEPTEMBER 2021 -
O termo neuroinflamação é usado com frequência, embora não haja
uma definição universalmente aceita. Conforme descrito em uma
revisão anexa, definimos neuroinflamação como uma resposta reativa
de células imunes e os mediadores que elas produzem (por exemplo,
citocinas, quimiocinas, espécies reativas de oxigênio e outros
mensageiros secundários), que causam inflamação do tecido neural.1
A neuroinflamação pode promover A agregação de α-sinucleína
(α-syn) para finalmente causar perda de células dopaminérgicas
(DA) na substância negra com agregados α-syn, denominados corpos de
Lewy, que são a marca registrada da doença de Parkinson (DP) .2 Foi
hipotetizado que α -syn patologia começa no intestino e viaja
através do nervo vago para entrar no sistema nervoso central (SNC)
no núcleo motor dorsal, embora isso tenha sido debatido desde
então.3 O tecido cerebral de pacientes com DP submetidos a
transplante nigral fetal mostrou aumento do citoplasma α-syn no
tecido transplantado, apoiando a teoria de que α-syn pode se
propagar entre as células, de forma semelhante aos príons.4 À
medida que a agregação de α-syn e os efeitos neuroinflamatórios
se acumulam, estes podem causar perda de células DA e sintomas e
sinais subsequentes de DP.5 Considerando esse possível mecanismo
patogênico, existem vários imunomoduladores - tratamentos que
aumentam ou suprimem várias etapas funcionais do sistema imunológico
- sob investigação para o tratamento de pacientes com DP, 6 que
revisamos aqui. Em um artigo anexo, revisamos as evidências para um
papel da neuroinflamação na patologia da DP.
Imunoterapia
visando α-sinucleína
Como os agregados de α-syn em corpos de
Lewy de DP são uma marca patológica da doença, a segmentação de
α-syn tem sido considerada uma terapia potencial. Anticorpos
monoclonais específicos direcionados a α-syn extracelular foram
estudados (Tabela). Estudos de fase 2 usando imunização passiva (ou
seja, infusão de anticorpos monoclonais) contra α-syn foram
conduzidos e 1 continua em um estudo aberto, mas outro foi encerrado
porque os alvos primários e secundários não foram atingidos.7,8
Estes anticorpos direcionados a diferentes regiões de α-syn.
Existem também estudos em andamento de imunização ativa novamente
α-syn.9
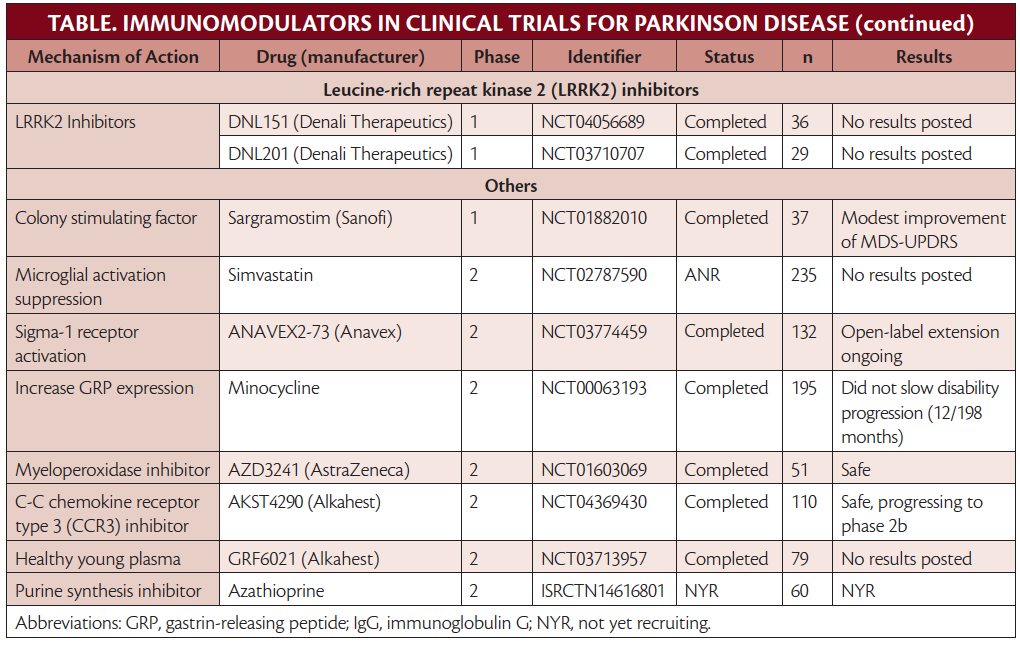
Outro medicamento que tem como alvo α-syn, o nilotinib, é um inibidor da região do breakpoint cluster (BCR) -Abelson tirosina quinase (c-Abl) que foi aprovado para uso como quimioterapia na leucemia mieloide crônica. O nilotinib ajuda a interromper a produção descontrolada de granulócitos em maturação (principalmente neutrófilos). Propriedades neuroprotetoras do nilotinib foram observadas com potencial para inibir a autofagia, agregação e propagação de α-syn. Em um estudo de fase 2, no entanto, houve preocupação com relação à penetração do nilotinib no cérebro, e não foi eficaz em retardar a progressão da doença.10,11 Os autores deste estudo alertaram que isso não refuta os potenciais efeitos neuroprotetores de outras moléculas que atuam no via c-Abl, e várias estão sob investigação (Tabela).
Mirando Microglia
A microglia contribui para a neuroinflamação por meio da liberação de espécies reativas de oxigênio (consulte também Neuroinflamação na doença de Parkinson nesta edição). A mieloperoxidase gera espécies reativas de oxigênio na microglia e tem sido alvo de ensaios clínicos com o inibidor de mieloperoxidase, AZD3241. Em um estudo de fase 2, o AZD3241 foi seguro e diminuiu plausivelmente a ativação da microglia, sugerindo que estudos adicionais são necessários. O ensaio de fase 3 em andamento, no entanto, não é para DP, mas sim para atrofia de múltiplos sistemas (MSA), um distúrbio de movimento neurodegenerativo diferente também caracterizado pela patologia α-syn.12
Linfócitos-alvo
A azatioprina (AZA) é um imunossupressor sistêmico sendo avaliado para tratamento de DP em um estudo duplo-cego de fase 2 controlado por placebo, incluindo 60 participantes com DP inicial. Como em muitos outros estudos, pessoas com outras condições imunológicas são excluídas da participação, o que pode excluir indivíduos com DP que podem estar em maior risco de autoimunidade e com maior probabilidade de se beneficiar de AZA ou outros imunomoduladores.13 Um pequeno ensaio clínico de fase 2 de 18 participantes avaliando o uso de plasma fresco congelado intravenoso de doadores jovens saudáveis, com idade entre 18 e 25 anos, foi concluído e relatou melhora da cognição em participantes com DP e comprometimento cognitivo. O plasma fresco congelado tem vários efeitos no sistema imunológico e consiste em imunoglobulinas de doadores saudáveis(IgGs) e outros componentes plasmáticos do plasma (por exemplo, fatores de coagulação). Os resultados não foram publicados em um jornal revisado por pares, embora um comunicado à imprensa afirme que o uso é seguro com resultados positivos.14 O inibidor de quimiocina, AKST4290, que inibe o receptor de quimiocina CC 3 para prevenir o recrutamento de células imunes, está sendo testado para o tratamento de PD em um estudo de fase 3 (Tabela).
Sargramostim é um fator estimulador de colônia de granulócitos-macrófagos recombinante humano que aumenta as células Treg e é aprovado para recuperação de medula óssea em indivíduos que realizaram transplante de medula óssea. Em um ensaio clínico de fase 1 em pessoas com DP, o sargramostim foi seguro e bem tolerado com melhorias modestas no perfil imunológico, por meio do aumento da função e frequência das células Treg, e também dos sintomas motores, embora fosse um tamanho de amostra pequeno.15 Não o ensaio de fase 2 foi registrado no banco de dados National Clinical Trials.
Citocinas de direcionamento
Vários estudos sugerem imunoterapias que bloqueiam citocinas pró-inflamatórias (por exemplo, fator de necrose tumoral [TNF] ou interleucina [IL] -1 podem ter benefícios protetores. Revisões retrospectivas mostraram que, embora a incidência de DP seja maior entre pacientes com colite ulcerativa ou doença de Crohn , esses pacientes diminuíram a prevalência de DP se expostos a esteroides ou terapia antiTNF.16,17 A metanálise mostrou que o uso de ibuprofeno foi associado a um menor risco de desenvolver DP.18
Acredita-se que o receptor do peptídeo 1 semelhante ao glucagon (GLP-1-R) reduza a apoptose celular (isto é, morte celular programada) que ocorre em resposta às citocinas inflamatórias. Com o objetivo de aumentar esse efeito neuroprotetor, vários agonistas de GLP-1-R estão sob investigação (Tabela) .19 Essa classe de medicamentos está aprovada para tratar diabetes. Em um ensaio clínico de fase 2, randomizado, duplo-cego, controlado por placebo e em local único, 60 participantes com DP foram tratados com o agonista GLP-1-R exenatida ou placebo por 48 semanas, seguido por um período de eliminação de 12 semanas. O tratamento com exenatida foi seguro e melhorou a função clínica, conforme medido com os escores motores da Escala de Avaliação da Doença de Parkinson Unificada da Sociedade de Distúrbios do Movimento (MDS-UPDRS) em comparação com o placebo.20 Um estudo de fase 3 de exenatida está em andamento e um estudo de fase 2 avaliando a segurança e eficácia de exenatida peguilada em pessoas com DP. Outros agonistas de GLP-1-R sendo estudados para potencial tratamento de DP incluem lixisenatida, liraglutida e semaglutida.21
Visando o Microbioma
Há uma série de pequenos estudos em andamento de agentes direcionados ao microbioma intestinal. O eixo intestino-cérebro é complexo e o microbioma afeta o sistema imunológico por meio da expressão de citocinas, iniciando o sistema imunológico adaptativo e ativando inflamassomas, entre outros mecanismos. Os estudos direcionados ao microbioma intestinal incluem, mas não estão limitados a, transplante microbiano fecal, rifaximina e maltodextrina. Um pequeno estudo de transplante fecal aberto, que altera o microbioma, em 15 participantes com DP mostrou melhora dos sintomas motores e não motores com eventos adversos limitados.21 Estudos de fase 2 nesta categoria estão em andamento, com muitos ainda recrutando.
Visando Genes Relacionados ao Imune e Parkinson
Mutações da proteína quinase 2 de repetição rica em leucina (LRRK2) estão entre as causas mais comuns de DP hereditária autossômica dominante. LRRK2 está implicado na inflamação neuronal e sistêmica via inibição lisossomal. As células imunes expressam altos níveis de LRRK2 e algumas variantes da mutação de LRRK2 estão associadas a um risco aumentado de doenças inflamatórias autoimunes do intestino.23,24 Existem 2 inibidores de pequenas moléculas potentes, seletivos e penetrantes no cérebro de LRRK2 sendo investigados. Os dados de segurança da Fase I foram relatados apenas em comunicados à imprensa que declararam que todas as metas de segurança e biomarcadores foram alcançadas, e que essas pequenas moléculas irão progredir para os testes de fase 2.25
Conclusão
Esses estudos mostram que há uma série de mecanismos complexos nos quais a neuroinflamação está implicada na patogênese da DP. Ainda existem muitos ensaios terapêuticos promissores de imunomoduladores. Os ensaios que foram concluídos com resultados negativos podem ser, em parte, devido ao momento subótimo da administração da terapia, considerando que há morte significativa de neurônios dopaminérgicos no momento em que os pacientes apresentam sintomas motores de DP e neuroinflamação foi implicada no estágios iniciais da patogênese da doença. Há uma série de outros medicamentos sob investigação que atuam no sistema imunológico com o objetivo de retardar a progressão da doença na DP, e esta não é uma lista completa (Tabela). Muitos outros imunomoduladores têm se mostrado promissores em contextos pré-clínicos e ainda não chegaram ao leito de pacientes com DP.26 Dados os vários mecanismos pelos quais a neuroinflamação leva à patogênese da doença em pacientes com DP, esses medicamentos fornecem uma fronteira promissora no tratamento da DP. Original em inglês, tradução Google, revisão Hugo. Fonte: Practicalneurology.
Nenhum comentário:
Postar um comentário