September 1, 2020 - Resumo - A estimulação cerebral profunda (DBS) está se tornando cada vez mais central no tratamento de pacientes com doença de Parkinson e outros distúrbios do movimento. Desenvolvimentos recentes no projeto do eletrodo DBS e do gerador de pulso implantável fornecem maior flexibilidade para a programação, melhorando potencialmente o benefício terapêutico da estimulação. Os eletrodos direcionais de DBS podem aumentar a janela terapêutica de estimulação, fornecendo um meio de evitar a propagação da corrente para estruturas que podem dar origem a efeitos colaterais relacionados à estimulação. Da mesma forma, o controle da corrente para contatos individuais em um eletrodo DBS permite a formação do campo elétrico produzido entre vários contatos ativos. A revisão a seguir tem como objetivo descrever os desenvolvimentos recentes na tecnologia do sistema DBS e os recursos de cada sistema DBS disponível comercialmente. As vantagens de cada sistema são revisadas e considerações gerais para a escolha do sistema mais apropriado são discutidas.
O desenvolvimento da estimulação cerebral profunda (DBS) há mais de 30 anos forneceu um meio de aliviar as condições de pacientes com uma variedade de distúrbios do movimento e desde então se tornou cada vez mais importante no tratamento da doença de Parkinson (DP) [1,2]. Os dois alvos mais comuns para DBS para DP são o globus pallidus internus (GPi) e o núcleo subtalâmico (STN). Embora ambos os alvos sejam eficazes para reduzir as discinesias induzidas pela levodopa e melhorar a mobilidade, o STN-DBS tem o benefício adicional de reduzir a necessidade diária de levodopa; por outro lado, o GPi é considerado um alvo mais seguro do ponto de vista psiquiátrico e cognitivo [3-5].
A cirurgia DBS tem se mostrado eficaz para melhorar os sintomas motores e a qualidade de vida de pacientes com DP; no entanto, existem alguns sintomas que podem ser resistentes ou refratários à estimulação. Por exemplo, marcha, fala e disfunção postural tendem a deteriorar-se independentemente e em um ritmo mais rápido do que os sintomas apendiculares [6]. O STN-DBS em particular é conhecido por exacerbar a gagueira e a hipofonia em pacientes com DP [7]. Além disso, a estimulação em contatos que residem em regiões específicas do STN pode ter efeitos diferenciais sobre os sintomas axiais e apendiculares. Por exemplo, a estimulação da metade dorsal do STN lateral mostrou melhorar a velocidade do passo, comprimento e equilíbrio em comparação com a estimulação das regiões ventrais [8]. O potencial do STN-DBS para afetar adversamente os sintomas axiais é exemplificado por um relato de caso em que o congelamento de novo da marcha (FOG - freezing of gait) foi produzido com estimulação da região anteromedial do STN [9]. Por outro lado, GPi DBS está associado a menos eventos adversos axiais, embora esta observação venha principalmente de estudos abertos não controlados [6]. Essas descobertas demonstram possíveis desafios que podem surgir ao otimizar as configurações de estimulação para pacientes individuais.
O potencial terapêutico do DBS depende fortemente do posicionamento ideal do eletrodo DBS dentro do núcleo alvo. Embora várias técnicas de localização, como orientação de imagem, gravações de microeletrodos e avaliação clínica, possam ser implementadas durante o procedimento cirúrgico, pequenos desvios da trajetória planejada podem resultar em uma janela terapêutica reduzida para estimulação. O STN é um pequeno núcleo em forma de lente medindo aproximadamente 8 mm de comprimento e 6 mm de largura que é dividido em regiões sensório-motoras dorsolaterais, associativas e límbicas medioventrais [10]. Estudos demonstraram que a implantação ideal do eletrodo na região dorsolateral do STN é necessária para produzir melhorias nos sintomas motores, evitando efeitos colaterais relacionados à estimulação [11,12]. As revisões do eletrodo DBS são incomuns devido ao risco de complicações cirúrgicas; assim, os médicos podem ter que confiar em estratégias de programação para otimizar o benefício terapêutico no caso de eletrodos DBS colocados de forma subótima.
A obtenção de uma resposta clínica ideal enquanto minimiza os efeitos colaterais relacionados à estimulação pode ser alcançada na maioria dos casos, manipulando os parâmetros de estimulação, como polaridade do eletrodo, frequência, largura de pulso e voltagem, bem como modelando o volume de ativação do tecido (VTA - volume of tissue activation) . Por exemplo, a estimulação bipolar pode estreitar a forma do VTA para evitar as fibras da cápsula interna ou outras estruturas eloquentes. Além disso, alguns estudos relataram melhorias na marcha com a mudança para estimulação de alta voltagem de baixa frequência (60 Hz) [13,14], em oposição aos protocolos padrão que implementam a estimulação de alta frequência (HFS). Recentemente, os avanços tecnológicos em sistemas DBS deram origem a estratégias de programação adicionais que permitem maior flexibilidade na manipulação de parâmetros de estimulação. Esses avanços podem ajudar os médicos a otimizar as configurações do programa para pacientes com sintomas parkinsonianos complexos ou eletrodos DBS posicionados de forma subótima. A presente revisão irá discutir novas técnicas de estimulação implementadas pela última geração de sistemas DBS com foco nas características exclusivas de cada sistema.
ATUALIZAÇÃO NA ESTIMULAÇÃO
Os objetivos da programação efetiva do DBS em ordem de importância são maximizar o benefício clínico, evitar os efeitos colaterais relacionados à estimulação e minimizar o consumo atual [15]. Em geral, a estimulação por meio de um eletrodo DBS posicionado de forma ideal deve produzir um benefício clínico significativo com consumo de energia relativamente baixo. A estimulação monopolar, na qual um (ou dois no caso de ‘duplo monopolar’) dos contatos do eletrodo serve como um cátodo contra o gerador de pulso implantável (IPG), produz uma difusão radial de corrente em torno do contato ativo. O raio do VTA aumenta com o aumento da amplitude (tensão ou corrente). Por outro lado, na estimulação bipolar, um contato serve como o cátodo, enquanto outro serve como o ânodo. Isso produz um VTA mais estreito com a maior força de campo centrada em torno do cátodo. A estimulação bipolar pode ser útil nos casos em que o VTA produzido pela estimulação monopolar viola as estruturas eloquentes circundantes, levando a efeitos colaterais. Curiosamente, a estimulação bipolar está associada a uma vida útil mais longa da bateria do que a estimulação monopolar dupla e até mesmo monopolar usando um IPG de tensão constante [16]. O benefício terapêutico do STN-DBS em pacientes com DP foi observado com frequências de estimulação maiores que 50 Hz, e melhorias clínicas na rigidez e bradicinesia são maximizadas em aproximadamente 130 Hz [17]. Por outro lado, a estimulação em 5 Hz foi observada para piorar os sintomas de rigidez e bradicinesia [17].
Corrente constante
Até recentemente, todos os DBS IPGs utilizavam estimulação controlada por tensão constante de fonte única. A consequência deste projeto é que a impedância do eletrodo DBS na interface de contato-tecido determina a magnitude do fluxo de corrente para os elementos neurais e esta impedância pode mudar ao longo do tempo (por exemplo, após substituições de IPG). Os IPGs atuais da Medtronic podem fornecer estimulação com constante de tensão ou com constante de corrente, mas a primeira é geralmente preferida, pois há mais opções de programação disponíveis. Atualmente, a maioria dos fabricantes produz apenas IPGs com constante de corrente.
Largura do pulso
A largura de pulso geralmente é mantida na duração mais baixa de 60 μs, a menos que haja falta de benefício clínico com o aumento da amplitude [15]. Enquanto a quantidade de corrente necessária para excitar o tecido neural diminui com o aumento da largura de pulso [18], a amplitude pode ser mais facilmente manipulada com a maioria dos IPGs [15]. O encurtamento da largura de pulso para <60 μs mostrou alguma utilidade no aumento da janela terapêutica de estimulação, ou seja, a faixa de amplitudes que produzem benefício clínico sem efeitos colaterais [19]. Larguras de pulso <60 μs só são possíveis com o uso de IPGs mais novos, alguns dos quais são compatíveis com eletrodos produzidos por diferentes fabricantes [20]. O encurtamento da largura de pulso abaixo de 60 μs demonstrou reduzir os efeitos colaterais relacionados à estimulação e aumentar a janela terapêutica de estimulação em dois pacientes com tremor essencial (TE) quando eles foram trocados de um Medtronic IPG para um Boston Scientific Vercise IPG [20].
Frequência
A frequência de estimulação variável foi recentemente explorada para tratar os sintomas da marcha e axiais em DP que responderam mal ao HFS tradicional de 130 Hz. DBS visando o núcleo pedunclopontino é um procedimento experimental previamente investigado para tratar FOG em pacientes com DP, e suas configurações de estimulação ideais utilizaram frequências mais baixas do que outros alvos, mais comumente frequências <60 Hz [21]. A estimulação de baixa frequência (LFS) foi hipotetizada para fornecer melhor controle dos sintomas axiais, incluindo FOG, mesmo quando entregue ao STN [13]. Em um pequeno estudo de 13 pacientes com DP com FOG e sintomas axiais proeminentes, o LFS melhorou a marcha e reduziu os episódios de congelamento, mantendo uma redução no escore motor da Escala de Avaliação Unificada de DP (UPDRS), embora a maioria dos pacientes tivesse que aumentar sua levodopa dose para mitigar o agravamento dos sintomas parkinsonianos [13]. Da mesma forma, o LFS foi encontrado para melhorar a marcha e os sintomas axiais em uma coorte de 14 pacientes, e os contatos ideais para LFS foram localizados ventralmente aos contatos para HFS ideal de 130 Hz [22]. A estimulação de frequência variável (VFS) envolve alternar HFS com LFS. Jia et al. [23] propuseram que a VFS pode servir como uma estratégia eficaz para o tratamento de FOG e sintomas axiais em pacientes com DP, mantendo o tratamento ideal dos sintomas apendiculares. Isso foi exemplificado em um caso de um paciente com DP com FOG que melhorou com VFS. Posteriormente, um pequeno estudo de caso de 4 pacientes com DP com sintomas de FOG demonstrou que o VFS melhorou a velocidade da marcha e reduziu os episódios de FOG [24]. Além disso, um estudo aberto agudo descobriu que a frequência de estimulação alta de 10 kHz foi relatada para produzir boa mobilidade com menos parestesias induzidas por estimulação e distúrbios da fala do que a frequência de estimulação tradicional de 130 Hz [25].
Fracionamento temporal
O fracionamento temporal envolve o uso de dois programas separados de forma alternada por meio de um único eletrodo DBS. Os dois programas podem ter diferentes amplitudes, polaridades e larguras de pulso; no entanto, a frequência deve ser a mesma, com uma frequência máxima permitida de 125 Hz (ou seja, a saída máxima do IPG é 250 Hz). Este método de estimulação permite que diferentes áreas do núcleo alvo sejam estimuladas simultaneamente. Esta tecnologia é geralmente conhecida como ‘estimulação de intercalação’ (interleaving stimulation), introduzida pela Medtronic; uma tecnologia semelhante é chamada de 'conjunto multi-stim' em dispositivos Abbott (veja abaixo).
Relatos de casos descreveram que a estimulação intercalada é eficaz no tratamento da distonia refratária [26] e no tratamento dos sintomas predominantes de tremor em um paciente com DP e TE (essential tremor) comórbidos [27]. Esta tecnologia pode ser particularmente útil nos casos em que um eletrodo DBS é colocado de forma subótima. Miocinovic et al. [28] descreveram 3 pacientes, cada um dos quais tinha um eletrodo DBS posicionado de forma subótima dentro do STN. A estimulação usando vários programas monopolar e duplo monopolar melhorou alguns sintomas, mas piorou outros e causou efeitos colaterais relacionados à estimulação. O uso de programas de intercalação foi eficaz para fornecer estimulação das áreas desejadas, evitando estruturas circundantes. Da mesma forma, Zhang et al. [29] relataram uma série de 12 pacientes nos quais vários ensaios de estimulação convencional foram ineficazes no controle de vários sintomas. Antes de implementar a estimulação interleaving ou intercalada, as queixas dos pacientes incluíam disartria, discinesias relacionadas à estimulação, distúrbios da marcha e controle incompleto dos sintomas parkinsonianos. A avaliação de ressonância magnética revelou uma colocação subótima do eletrodo afetado na maioria dos pacientes desta série; entretanto, o controle adequado dos sintomas pode ser alcançado em todos com a estimulação intercalada. Além de evitar os efeitos colaterais relacionados à estimulação, a estimulação intercalada demonstrou melhorar as discinesias em um subconjunto de pacientes com DP. Curiosamente, este efeito foi alcançado com a ativação de um contato dorsal residindo na zona incerta, logo fora do STN [30]. Esses relatórios exemplificam como a intercalação fornece maior flexibilidade na programação, permitindo ao médico equilibrar melhor os sintomas parkinsonianos e os efeitos colaterais relacionados à estimulação.
Fracionamento atual
O conceito de fracionamento de corrente envolve várias fontes de corrente independentes que aplicam corrente constante através de cada eletrodo, permitindo ao médico controlar diretamente a quantidade de corrente fornecida aos tecidos circundantes. O controle do fluxo de corrente através de cada contato individualmente é denominado controle de corrente independente múltiplo (MICC - multiple independent current control) no Boston Scientific IPGs. Utilizando este paradigma, a corrente pode ser distribuída de forma controlada entre vários contatos, permitindo que o VTA seja ajustado para um formato desejado para se ajustar à região alvo [31]. O fracionamento atual é diferente do fracionamento temporal, que usa tecnologias como intercalação (veja acima).
MICC não é possível em dispositivos Abbott, que usam um método diferente - menos versátil - chamado de coativação.
Coativação
A coativação permite que múltiplos contatos sejam estimulados como se fossem um único eletrodo (veja abaixo). Em um estudo de modelagem, a coativação mostrou estar associada a um menor consumo de energia do que o MICC devido à impedância reduzida na interface eletrodo-tecido [32].
Modelos computacionais demonstraram que a direção de corrente contínua pode ter o potencial de estimular as populações neuronais desejadas, mesmo no caso de eletrodos DBS colocados de forma subótima [31,33]. Na verdade, com base nesses modelos, a estimulação terapêutica seletiva pode ser alcançada em uma variedade de localizações de eletrodos [33]. A utilidade deste método de estimulação foi demonstrada em algumas séries de casos e relatos de casos. Por exemplo, a direção atual para deslocar a estimulação em direção a um contato mais proximal, mudando a forma do VTA para uma distribuição em forma de lágrima foi usada em um paciente que desenvolveu discinesias com amplitude crescente em seu contato terapêutico mais usado. Isso efetivamente aliviou os sintomas parkinsonianos do paciente, sem provocar discinesias [34].
No entanto, alvejar com tal precisão exigiria informações detalhadas sobre a localização do eletrodo dentro do núcleo alvo do indivíduo e, consequentemente, pode complicar o processo de programação. Os autores sugerem que o software de visualização pode ajudar a guiar os médicos por meio de modelos computacionais específicos do paciente durante o processo de programação [33]. Por exemplo, o sistema GUIDE da Boston Scientific (Valencia, CA, EUA) é um software visual tridimensional que fornece informações sobre a localização do eletrodo DBS com base em imagens de ressonância magnética pré-operatória e tomografia computadorizada pós-operatória. O VTA pode ser modelado quando as configurações de estimulação são selecionadas, permitindo que os médicos visualizem o VTA resultante em relação às estruturas circundantes. O uso deste software de programação reduziu a duração da sessão de programação inicial em 75% [35].
Estimulação anódica
Tradicionalmente, a estimulação catódica tem sido favorecida, uma vez que a ativação das fibras mielinizadas requer de 3 a 8 vezes mais força de estimulação quando o contato ativo atua como um ânodo [36]. Por esta razão, os sistemas DBS de primeira geração foram projetados de forma que o caso IPG servisse como ânodo, enquanto o contato ativo servisse como cátodo. Teoricamente, o contato ativo em um eletrodo DBS pode atuar como um cátodo ou um ânodo. Acredita-se que a estimulação catódica e anódica afetam diferencialmente o tecido neural dependendo da orientação das fibras, de modo que as fibras que passam são ativadas por estimulação catódica e as fibras ortogonalmente orientadas são ativadas por estimulação anódica [37]. Com o recente desenvolvimento de sistemas DBS de segunda geração que permitem maior flexibilidade nos parâmetros de estimulação, os efeitos da estimulação anódica em comparação com a estimulação catódica foram estudados [38,39]. Kirsch et al. [38] estudaram a estimulação anódica em 10 pacientes com DP e relataram limiares de efeitos colaterais mais altos e escores motores UPDRS III mais baixos com estimulação anódica do que com estimulação catódica. Outro estudo envolvendo 10 pacientes com DP encontrou uma janela terapêutica aumentada e um limiar mais alto de efeitos colaterais com estimulação anódica [39]. No entanto, a estimulação anódica não foi capaz de controlar os tremores em dois pacientes, e a estimulação anódica também é conhecida por resultar em maior consumo de bateria [39].
Estimulação semibipolar
Na estimulação semibipolar, o ânodo é dividido igualmente entre o caso IPG e outro contato no eletrodo DBS. Com base na experiência clínica, acredita-se que essa configuração seja útil para evitar efeitos colaterais relacionados à estimulação. Soh et al. [39] compararam os efeitos da estimulação semibipolar com a estimulação bipolar, catódica monopolar e anódica monopolar em um grupo de estudo de 10 pacientes com DP. A estimulação semibipolar apresentou um limiar de efeito colateral significativamente maior do que a estimulação catódica; além disso, a estimulação semibipolar apresentou menor consumo de bateria do que a estimulação bipolar [39].
Eletrodos direcionais
O projeto do eletrodo do DBS apresentou um crescimento significativo nos últimos anos com o desenvolvimento de eletrodos direcionais disponíveis comercialmente. A estrutura do condutor DBS tradicional consiste em 4 contatos de 1,5 mm de comprimento separados um do outro por espaços de 1,5 mm no caso do modelo Medtronic 3387 e de 0,5 mm no caso do modelo Medtronic 3389. Conforme descrito anteriormente, a estimulação monopolar produz um campo elétrico esférico que se difunde radialmente a partir do contato ativo. Os condutores direcionais, por outro lado, contêm vários contatos em uma distribuição radial ao redor do eixo do condutor DBS. Cada contato pode ser estimulado individualmente ou em combinação por meio de fracionamento temporal (dispositivos Abbott) ou fracionamento de corrente (MICC, Boston Scientific). A passagem de corrente através de contatos individuais permite a corrente
A passagem da corrente pelos contatos individuais permite o direcionamento da corrente ao longo de um vetor perpendicular ao condutor. Os condutores direcionais disponíveis comercialmente têm uma configuração de anel circunferencial composta de 3 contatos individuais. A estimulação através de todos os 3 contatos simultaneamente produz um campo elétrico equivalente ao da estimulação monopolar por meio de um eletrodo DBS tradicional. É importante ressaltar que o menor tamanho de cada contato individual leva a uma maior densidade de campo elétrico na interface contato-tecido; portanto, menos corrente é necessária para produzir um efeito terapêutico. Este recurso pode contribuir potencialmente para preservar a vida útil da bateria.
A vantagem do projeto do eletrodo direcional foi proposta pela primeira vez por modelos computacionais [40,41]. Um desses modelos sugeriu que a direção da corrente através de eletrodos segmentados poderia deslocar o centro do VTA em até 1,0-1,3 mm [42]. Embora essa distância possa parecer insuficiente para compensar um eletrodo DBS mal posicionado, estudos em seres humanos demonstraram que a estimulação direcional por meio de um contato mais favorável pode aumentar a janela terapêutica para estimulação e aumentar o limite atual para a produção de efeitos colaterais [43-45].
Dois estudos iniciais realizados em pacientes com DP foram apenas intraoperatórios [44,46]. Pollo et al. [44] calcularam que a janela terapêutica média foi 41,3% maior do que a estimulação omnidirecional, e a corrente terapêutica média foi 43% menor para a melhor estimulação direcional do que para a estimulação omnidirecional. Contarino et al. [46] encontraram resultados semelhantes em um estudo intraoperatório duplo-cego em oito pacientes com DP por meio de um eletrodo de 32 contatos não comercializado. Dembek et al. [43] investigaram o benefício clínico da estimulação direcional em um estudo duplo-cego cruzado crônico no qual os pacientes receberam um ensaio de melhor estimulação direcional em comparação com a omnidirecional. Este grupo não encontrou nenhuma diferença nos resultados motores entre as duas condições, exceto uma diferença positiva significativa na rotação da mão na condição direcional.
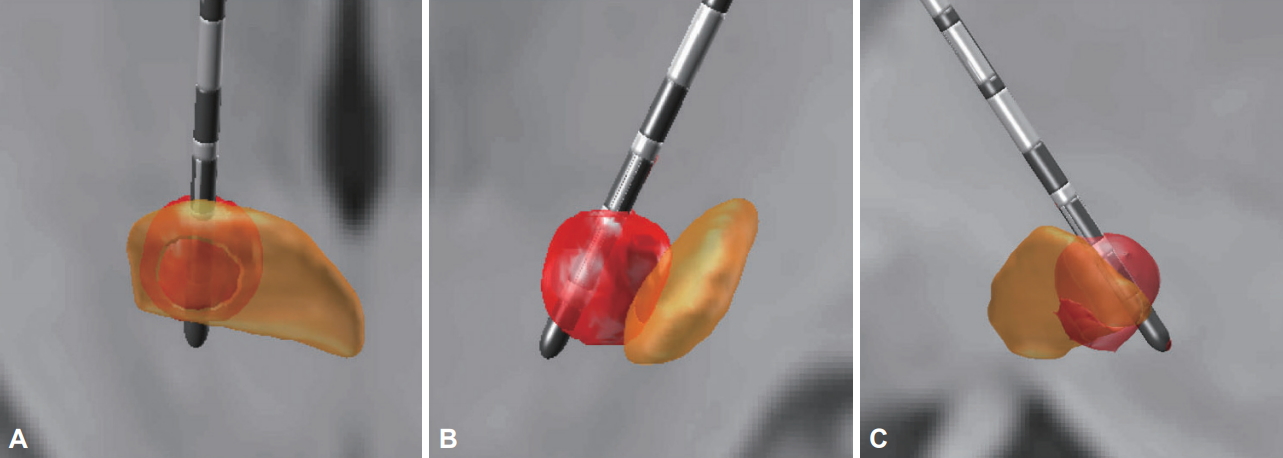
A utilidade dos eletrodos direcionais para STN-DBS foi demonstrada no estudo PROGRESS, no qual 234 pacientes com DP foram implantados com eletrodos direcionais Abbott direcionados ao STN [47]. Durante os primeiros três meses, os pacientes receberam estimulação omnidirecional tradicional e, durante o período de 3 meses seguinte, os pacientes foram trocados para a estimulação direcional. Os resultados deste estudo prospectivo cruzado de braço único produziram um aumento médio significativo de 41% na janela terapêutica para estimulação com estimulação direcional. Além disso, a quantidade de corrente necessária para produzir efeitos terapêuticos foi reduzida em 39% [47]. A capacidade e limitação dos condutores direcionais para a corrente de direção, no caso de um condutor DBS mal colocado, está representada na Figura 1.
Figura 1.A: Estimulação do STN dorsolateral por meio de um eletrodo DBS posicionado de maneira ideal. B: O direcionamento da corrente através de uma derivação DBS direcional não é capaz de compensar uma derivação mal colocada que reside fora do núcleo alvo. C: O uso de direcionamento de corrente por meio de um eletrodo direcional posicionado ligeiramente posterior ao STN é capaz de direcionar a corrente para o STN dorsolateral. STN: núcleo subtalâmico, DBS: estimulação cerebral profunda.
Uma desvantagem potencial dos eletrodos direcionais é o aumento da complexidade da programação devido à adição de vários contatos direcionados em diferentes orientações. Felizmente, a revisão monopolar pode ser realizada de maneira semelhante aos tipos de eletrodos tradicionais, e a estimulação direcional pode ser implementada apenas se necessária para tratar os efeitos colaterais ou sintomas complexos. Algoritmos que implementam modelos anatômicos baseados em imagens de ressonância magnética e tensor de difusão para automatizar a programação do eletrodo direcional foram propostos [48]. No entanto, é provável que o acesso a essa tecnologia seja um fator limitante para muitos neurologistas comunitários.
Fabricantes de sistema DBS (segue um compilado dos geradores de pulso implantáveis de diferentes fabricantes com seus potenciais de programação e sua características técnicas)
Medtronic, Dublin, Ireland;
Abbott, (St. Paul, MN, USA);
Boston Scientific;
PINS Medical Co., Ltd. (Beijing, China);
SceneRay Co., Ltd. (Suzhou, China).
Tabela 1: Características dos geradores de pulso implantáveis disponíveis atualmente
(ver na fonte Table 1)
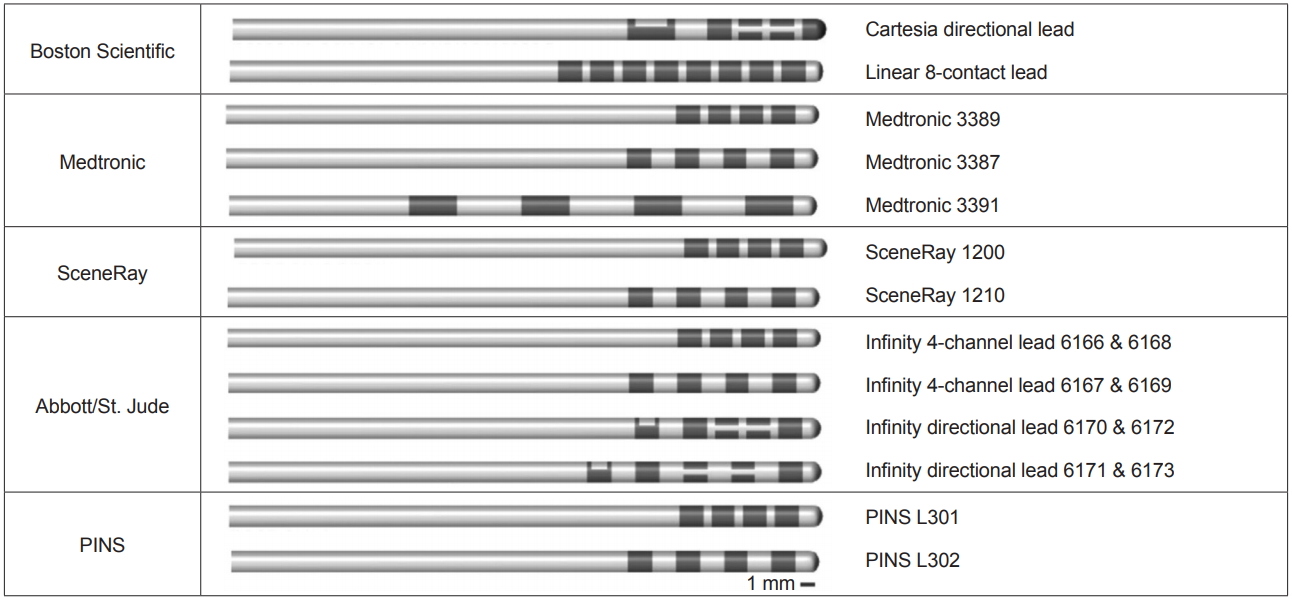
Figura 2.Representação visual em escala dos eletrodos de estimulação cerebral profunda atualmente disponíveis no mercado. As características e medidas de cada tipo de eletrodo estão resumidas na Tabela 2. (na fonte)
ESCOLHENDO O MELHOR SISTEMA
Muitos fatores podem contribuir para a escolha do sistema, incluindo o alvo anatômico, fatores do paciente e preferências do cirurgião e do neurologista. A escolha de usar eletrodos quadripolares tradicionais versus eletrodos direcionais é mais aplicável quando se considera o tamanho do núcleo alvo e o potencial para efeitos colaterais relacionados à estimulação. Por outro lado, os fatores do paciente são importantes ao considerar o uso de um IPG recarregável e não recarregável. Embora dispositivos recarregáveis sejam propostos para reduzir o número de trocas de bateria, poupando o paciente de procedimentos cirúrgicos repetidos, os pacientes devem ser confiáveis e capazes de recarregar a bateria de forma consistente. Embora o Medtronic Activa RC e o Boston Scientific Gevia exijam a cobrança apenas uma vez por semana, os pacientes com deficiência ou sem apoio social podem ter dificuldade em assumir essa responsabilidade. Além disso, a escolha do sistema DBS depende muito das preferências e do conforto dos cirurgiões e neurologistas responsáveis pelo tratamento. Muitos médicos têm vasta experiência no uso do sistema Medtronic, pois a Medtronic dominou o mercado nas últimas décadas. Pacientes que vivem em regiões remotas ou que têm probabilidade de se mudar podem descobrir que os dispositivos da Medtronic estão mais amplamente disponíveis.
Considerações anatômicas
O STN é um núcleo pequeno, medindo apenas 6-8 mm em sua maior dimensão. Uma trajetória típica de um eletrodo DBS através do STN começa na borda dorsolateral e se projeta medial e ventralmente, evitando idealmente as regiões associativa e límbica. Envolvendo o núcleo lateralmente e, até certo ponto, anteriormente, está a cápsula interna. Um eletrodo posicionado muito lateralmente dentro do STN pode produzir contrações contralaterais na face e nos membros por meio da propagação da corrente para as fibras da cápsula interna. Um eletrodo posicionado muito medial pode estimular as fibras do trato oculomotor adjacente, resultando em desvio ocular e diplopia. Além disso, houve relatos de estimulação de contatos localizados ventralmente causando episódios hipomaníacos agudos [64], bem como estimulação da substância negra subjacente, resultando em hipomania e depressão [65,66]. Eletrodos posicionados anteriormente podem se projetar na região hipotalâmica lateral, levando a efeitos autonômicos relacionados à estimulação, como sudorese e náusea.
O GPi, ao contrário do STN, é um alvo maior associado a uma menor incidência de efeitos colaterais. A cápsula interna faz fronteira com o GPi anteriormente e medialmente, e o trato óptico está localizado ventralmente. Também localizado ventralmente ao GPi está a ansa lenticularis, que separa o GPi do núcleo basal de Meynert e da amígdala. Uma trajetória típica do eletrodo DBS se estende ao longo do aspecto póstero-lateral do GPi e apenas dorsal ao trato óptico. Embora os efeitos colaterais sejam geralmente raros, a colocação medial ou posterior do eletrodo DBS pode resultar em estimulação capsular e contrações contralaterais da face e dos membros, e o desvio ventral pode produzir fosfeno e fenômenos visuais.
O potencial para efeitos colaterais relacionados à estimulação com STN-DBS pode justificar a consideração de eletrodos DBS direcionais. Um ponto técnico a ser considerado ao implantar eletrodos direcionais é que o segundo e terceiro níveis de contatos contêm os contatos direcionais, de modo que o eletrodo pode precisar ser implantado mais profundamente do que o normal para colocar os contatos direcionais na região alvo.
Outra estratégia potencial para aumentar a janela terapêutica para estimulação, evitando efeitos colaterais induzidos por estimulação, é o uso de larguras de pulso menores <60 μs. Estudos experimentais em animais demonstraram que os axônios são mais excitáveis do que os corpos celulares [18], e o limiar para ativação de elementos neurais varia com a força do estímulo e a largura do pulso. Larguras de pulso mais longas podem facilitar a estimulação de diâmetros maiores, axônios mielinizados, como aqueles que surgem dos tratos piramidais, e larguras de pulso mais curtas são consideradas direcionadas à corrente para corpos celulares e axônios menores. Reich et al. [19] observaram uma relação inversa entre a duração da largura de pulso e o limite para efeitos colaterais em um grupo de estudo de quatro pacientes com STN-DBS. Os autores implementaram o sistema de neuroestimulação Boston Scientific Vercise para entrega de larguras de pulso <60 μs e observaram um aumento de duas vezes na janela terapêutica de estimulação com uma largura de pulso de 30 μs em comparação com a largura de pulso padrão de 60 μs. Atualmente, os sistemas Boston Scientific Vercise e Abbott Infinity permitem larguras de pulso menores que 60 μs.
IPGs recarregáveis vs. não recarregáveis
O IPG não recarregável mais comum, o Medtronic Activa PC, tem uma vida útil média da bateria variando de 2,6 a 4,5 anos [60,61,67,68], que é aproximadamente 2,5 anos mais curta do que seu antecessor, o Kinetra [61]. Isso é consideravelmente mais curto do que a vida útil comercializada do PC, que é anunciada em aproximadamente 5 anos.
A vida útil de um IPG é amplamente dependente das demandas atuais das configurações de estimulação do paciente, com a estimulação de alta voltagem exigindo trocas de bateria mais frequentes. IPGs recarregáveis foram introduzidos pela primeira vez em 2008, e a vida útil prevista de IPGs recarregáveis de acordo com os fabricantes varia de 10 para Brio (Abbott / St. Jude) a 15 (Medtronic), até 25 (Boston Scientific) anos, que ainda não foi confirmado.
O objetivo dos IPGs recarregáveis é reduzir o número de trocas de bateria, o que pode reduzir os custos associados a vários procedimentos cirúrgicos e minimizar as chances de infecções de hardware. Alguns estudos relataram um aumento na incidência de infecções com substituições repetidas de IPG [69,70], mas um estudo não encontrou tal associação [71]. No entanto, o uso de um IPG recarregável durante um período de 9 anos (a vida útil inicialmente aprovada do Activa RC) foi estimado para levar a uma economia de $ 60.900 com base em um estudo de centro único envolvendo 206 pacientes [72]. Desde que IPGs recarregáveis se tornaram disponíveis, muitos pacientes mudaram para dispositivos recarregáveis e alguns até receberam IPGs recarregáveis durante o implante inicial de DBS [72,73]. Pesquisas com pacientes demonstraram que a grande maioria dos pacientes considera o processo de recarga fácil e a incidência de eventos adversos e interrupções temporárias na terapia é baixa [67,72,73].
A decisão de usar um IPG recarregável em vez de um não recarregável é geralmente deixada ao critério do médico assistente e pode ser influenciada pelos requisitos atuais das configurações de estimulação, bem como pela confiabilidade do paciente para recarregar seu dispositivo (Tabela 3). O Multi-Recharge Trial, conduzido em quatro centros neurocirúrgicos em toda a Alemanha, relatou os resultados da pesquisa de 56 pacientes trocados para IPGs recarregáveis e 139 pacientes que receberam IPGs recarregáveis durante a implantação de DBS [67]. De acordo com os resultados da pesquisa, os pacientes carregaram seus IPGs uma vez a cada 10 ± 8 dias e gastaram uma média de 122 ± 175 minutos por semana recarregando seus dispositivos. Pacientes com distonia descobriram que o processo de recarga é significativamente mais conveniente do que pacientes com DP.
Curiosamente, descobriu-se que o Activa RC requer muito mais tempo de carregamento por semana do que o Boston Scientific Vercise e o Abbott (St. Jude) Brio. Embora falhas de carregamento fossem incomuns, eram mais prováveis de ocorrer com pacientes que mudaram de um IPG não recarregável. Embora a decisão de usar um IPG recarregável deva levar em consideração os fatores do paciente, os resultados desses estudos sugerem que os IPGs recarregáveis são eficazes e fáceis de gerenciar, mesmo em pacientes mais velhos [67,73].
CONCLUSÕES
Os avanços tecnológicos em hardware e software DBS atualmente compreendem a maior área de crescimento dentro do campo da neurocirurgia funcional. Embora os estudos que avaliam os recursos dos novos sistemas DBS tenham encontrado ganhos nas medidas de estimulação eficaz, mais pesquisas são necessárias para caracterizar o impacto dessas tecnologias nos resultados dos pacientes e na qualidade de vida. Em um estudo transversal, com base em questionário e de pequena amostra, verificou-se que os pacientes tratados com um sistema DBS estabelecido (Medtronic) estavam menos inclinados a pensar que a programação adicional levaria a melhorias adicionais, sugerindo assim que os recursos adicionais do dispositivos mais novos podem complicar a programação DBS dos pacientes, aumentando o número de visitas necessárias para convencer os pacientes de que a estimulação é otimizada e, portanto, possivelmente aumentando as frustrações de médicos e pacientes [74].
Muitos dos recursos desses novos sistemas concentram-se atualmente em minimizar os efeitos colaterais relacionados à estimulação. É necessária uma compreensão mais aprofundada da fisiopatologia desses distúrbios - e da DP em particular - para determinar se a terapia com DBS é capaz de abordar os sintomas refratários aos medicamentos padrão ou DBS, como instabilidade postural, ataxia e FOG. A exploração de outros alvos cirúrgicos, como o substancial nigra pars reticulata [75,76] e o núcleo pedunculopontino [77,78], buscou abordar o FOG resistente à levodopa na DP. Com a pesquisa contínua, percepções mais profundas sobre as redes neurais que contribuem para esses distúrbios em sinergia com os avanços na tecnologia de estimulação, esperançosamente, produzirão novas terapias que podem melhorar a qualidade de vida desses pacientes.
Seguem Notas, agradecimentos e referências bibliográficas. Original em inglês, tradução Google, revisão Hugo. Fonte: Journal of Movement Disorders.