por Michael S. Okun, M.D.
October 9, 2014 - Scribonius Largus, o médico da corte do imperador romano Cláudio, usou um peixe-torpedo elétrico em 50 d.C. para tratar dores de cabeça e gota. Mais de 1000 anos se passaram antes que a ideia de estimulação cerebral terapêutica fosse reacendida. Em 1786, Luigi Galvani demonstrou que ele poderia conduzir eletricidade através dos nervos na perna de um sapo. Mais tarde, Alessandro Volta conduziu a corrente elétrica através de fios e construiu fontes de bateria rudimentares, mas eficazes. No entanto, nenhum desses pesquisadores poderia ter previsto a utilidade de sua tecnologia no tratamento de doenças humanas, aplicando uma corrente elétrica no cérebro humano.
O Prêmio Lasker-Debakey de Pesquisa Médica Clínica deste ano, anunciado em 8 de setembro, reconhece as contribuições de dois pioneiros da estimulação cerebral profunda (DBS): Alim-Louis Benabid, um neurocirurgião, e Mahlon DeLong, um neurologista. Sua pesquisa e sua tradução na prática clínica melhoraram as vidas de mais de 100.000 pessoas com doença de
Parkinson ou outros distúrbios neurológicos ou neuropsiquiátricos.
Normalmente, as pessoas com doença de
Parkinson recebem o diagnóstico na sexta ou sétima década de vida. A idade é o fator de risco mais importante para a doença, e estima-se que 1 a 2% das pessoas com mais de 60 anos de idade sejam afetadas. A deficiência associada à doença de
Parkinson decorre de um amplo espectro de sintomas motores (rosto mascarado, voz suave, tremor, caligrafia pequena, rigidez, bradicinesia, distonia, problemas de equilíbrio e passos embaralhados) e sintomas não motores (depressão, ansiedade, apatia, desordem do sono, e dificuldades cognitivas), bem como problemas do sistema nervoso autônomo (disfunção sexual, constipação, problemas gastrointestinais e hipotensão ortostática). De cada três pacientes diagnosticados com doença de
Parkinson, um fica desempregado em um ano e a maioria fica desempregada depois de 5 anos. Em média, os pacientes com doença de
Parkinson gastarão de US $ 1.000 a US $ 6.000 por ano com medicamentos, e seu risco anual de hospitalização será superior a 30%.
Antes do final dos anos 1960, os pioneiros seccionaram as vias motoras do cérebro humano, e pesquisadores posteriores ablaram intencionalmente muitas regiões de gânglios da base com álcool ou a aplicação de calor. No entanto, essa abordagem encontrou um sucesso limitado, em parte devido à segmentação imprecisa, imprecisa e inconsistente. Além disso, lesões cerebrais bilaterais criadas intencionalmente freqüentemente levavam a déficits irreversíveis na fala, na deglutição e na cognição. Esta abordagem cirúrgica desvaneceu-se em popularidade com a descoberta da levodopa (substituição da dopamina).
Antes da introdução da levodopa, a vida dos pacientes com doença de
Parkinson era terrível. Muitos foram internados. Após a levodopa, tornou-se rotina para os pacientes com doença de
Parkinson “despertarem” dos estados congelados, e quase todos puderam viver em casa. Os tremores diminuíram, a rigidez diminuiu e muitos pacientes recuperaram a capacidade de andar. No entanto, desafios importantes e inesperados surgiram. As mais preocupantes foram as complicações induzidas por medicamentos relacionadas à dopamina. Os pacientes começaram a relatar flutuações (com o desaparecimento das doses (n.t.: estado “off”), o congelamento (especialmente ao andar) e os movimentos semelhantes a danças (coreia), mais tarde denominados discinesia induzida por levodopa. Muitos relataram tremores que não responderam à farmacoterapia. Além disso, houve uma percepção crescente de que a levodopa não era uma cura e que a doença progrediu apesar do “despertar” milagroso.
No início dos anos 1970, pouco depois da introdução da levodopa, Mahlon DeLong começou a estudar uma área complexa e negligenciada do cérebro. No momento em que DeLong se juntou ao laboratório de Edward Evarts no National Institutes of Health, todas as “coisas boas” (como o córtex motor e o cerebelo) foram atribuídas a outros pesquisadores. Ele estava preso com os gânglios basais. A escassez de conhecimento até mesmo da anatomia e fisiologia normal dessa parte do cérebro não impediu DeLong, que publicou uma descrição seminal dos padrões de atividade elétrica nos neurônios dos gânglios da base dos primatas e uma descrição completa das respostas desses neurônios ao movimento.
Figura 1 (veja na fonte)
DeLong, junto com Garrett Alexander e Peter Strick, quebraram a pesquisa aberta sobre gânglios da base e doença de
Parkinson em 1986, quando introduziram a hipótese do circuito segregado - a ideia de que os gânglios basais e áreas associadas do córtex e tálamo poderiam ser divididos em territórios separados, com pequenas conversas funcionais ou anatômicas.1 Essa observação propiciou um novo entendimento das redes neurais humanas, abrindo caminho para a modulação elétrica. Também esclareceu que muitos dos sintomas de doenças neurológicas e neuropsiquiátricas podem estar associados à disfunção em circuitos cerebrais gânglio-basais específicos. DeLong, Hagai Bergman e Thomas Wichmann testaram essa hipótese destruindo o núcleo subtalâmico em um modelo primata da doença de
Parkinson e demonstrou melhora nos sintomas da doença.2 Logo depois, a eletricidade foi introduzida como uma abordagem baseada em modulação para os circuitos cerebrais na doença de
Parkinson (ver Figura 1). Um neurocirurgião francês, Alim-Louis Benabid, daria o passo corajoso de deixar um fio que pudesse fornecer corrente elétrica contínua dentro de um cérebro humano.
Em 1987, Benabid operou um homem idoso que tinha tremor. Ele já havia criado uma lesão cerebral para tratar esse tremor, mas estava preocupado com os potenciais efeitos adversos associados a fazer o mesmo no outro hemisfério. E assim, em um segundo procedimento, ele abordou o tremor contralateral. Ele passou por uma grande sonda de teste vários centímetros abaixo da superfície do cérebro. Ele sabia de cirurgias anteriores que a estimulação de baixa frequência piorava o tremor e que pulsos mais rápidos o suprimiam. Benabid deixou um neuroestimulador no cérebro do homem. Ele implantou um fio com quatro contatos de metal em sua ponta. Este fio, o cabo DBS, foi então conectado a uma fonte de bateria externa. Benabid e seus colegas programaram o dispositivo usando uma pequena caixa com botões e interruptores de aparência arcaica. Tão simples quanto o sistema, acabou sendo muito poderoso, permitindo que Benabid e Pierre Pollack individualizassem as configurações; os resultados são descritos em vários artigos seminais.3,4
Embora a biologia e os mecanismos que sustentam a terapia com DBS permaneçam incertos, sabemos agora que a função normal do cérebro humano é amplamente mediada por oscilações rítmicas que se repetem continuamente. Essas oscilações podem mudar e modular, afetando as funções cognitivas, comportamentais e motoras. Se uma oscilação for ruim, pode causar um tremor incapacitante ou outro sintoma da doença de
Parkinson. Circuitos cerebrais invasores presos em estados de oscilação anormal em muitas doenças tornaram-se candidatos à terapia com DBS. Alterações na neurofisiologia, neuroquímica, estruturas neurovasculares e neurogênese também podem sustentar os benefícios da terapia com DBS.5
Antes do desenvolvimento do DBS terapêutico, neurologistas, neurocirurgiões, psiquiatras e terapeutas de reabilitação trabalhavam em grande parte isolados uns dos outros no tratamento de pacientes com doença de
Parkinson. O sucesso da terapia com DBS estimulou a formação de equipes multidisciplinares, cujos membros avaliam candidatos ao DBS e, em conjunto, personalizam a terapia. Essa personalização inclui selecionar, com base nos sintomas, as regiões do cérebro para direcionar e planejar os cuidados pré e pós-operatórios. Embora as equipes de DBS geralmente tenham muitos membros, acredito que o elemento mais importante para o sucesso tenha sido a parceria entre neurologista e neurocirurgião. Portanto, é apropriado que o Prêmio Lasker para terapia DBS tenha sido dado a um neurologista e a um neurocirurgião.
Figura 2 (veja na fonte)
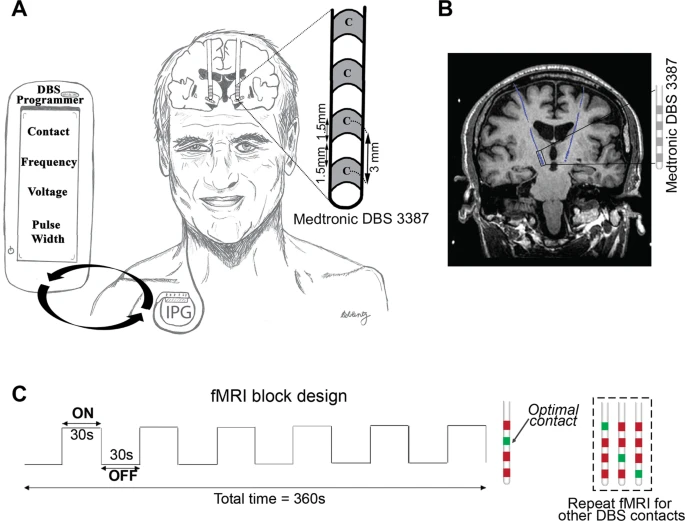
Dispositivos para DBS.
Unidades menores, mais elegantes e com maior eficiência energética estão no horizonte. Melhores projetos de eletrodos permitirão choques mais precisos. O monitoramento em tempo real da fisiologia do circuito neural está direcionando o campo para tecnologias mais inteligentes. A monitoração remota e o ajuste de dispositivos podem se tornar possíveis. Em sua forma atual, no entanto, a tecnologia tem várias limitações. A corrente pode se espalhar para regiões não intencionais do cérebro, causando efeitos colaterais, e o DBS geralmente não trata efetivamente todos os sintomas. Mais comumente, a fonte da bateria para neuroestimuladores é colocada na região subclavicular (ver Figura 2), mas essa configuração tem sido associada a altos riscos de fratura e infecção do eletrodo (n.t.: desconheço).
No entanto, o DBS teve um enorme efeito no tratamento da doença de
Parkinson. Também tem sido usado para tratar tremor essencial, distonia e epilepsia e em tratamentos experimentais de transtorno obsessivo-compulsivo, depressão, doença de Alzheimer e síndrome de Tourette (veja gráfico interativo, disponível com o texto completo deste artigo no NEJM.org). A terapia com DBS é geralmente considerada apenas após todos os outros tratamentos terem sido esgotados, mas ao tornar-se “biônica”, forneceu a muitos pacientes uma nova vida. Graças em grande parte às contribuições de dois cientistas extraordinários, entramos na era da modulação da rede neural humana.
Os formulários de divulgação fornecidos pelo autor estão disponíveis com o texto completo deste artigo no NEJM.org.
Este artigo foi publicado em 8 de setembro de 2014, no NEJM.org.
Original em inglês, tradução Google, revisão Hugo. Fonte:
NEJM, com imagens.