18/01/2022 - Relatos de casos de pacientes relativamente jovens com covid-19 que desenvolveram a doença de Parkinson semanas após a contração do vírus levaram os cientistas a se perguntar se poderia haver uma ligação entre as duas condições.
Agora, pesquisadores relatando na ACS Chemical Neuroscience mostraram que, pelo menos no tubo de ensaio, a proteína N do SARS-CoV-2 interage com uma proteína neuronal chamada α-sinucleína e acelera a formação de fibrilas amiloides, feixes de proteínas patológicas que implicam na doença de Parkinson.
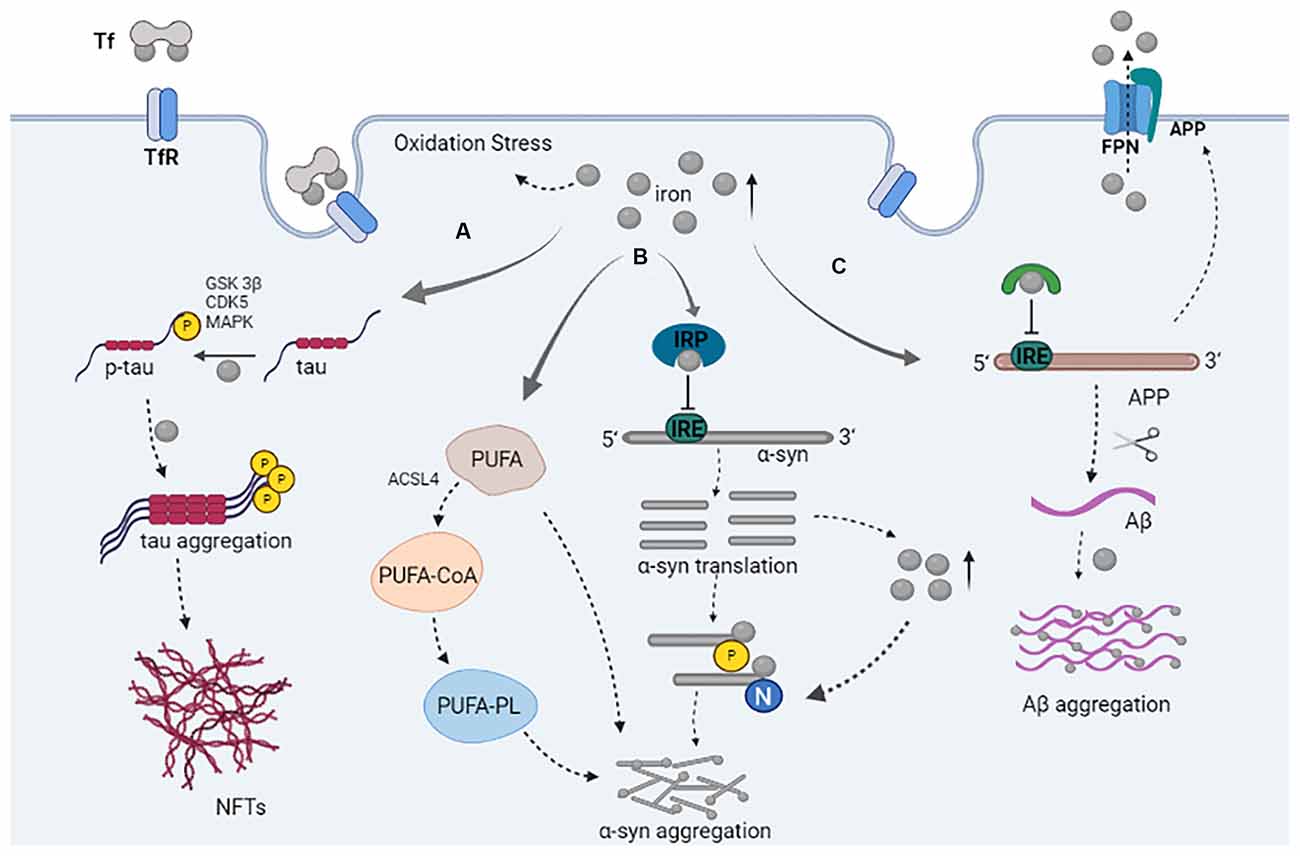
Além dos sintomas respiratórios, o SARS-CoV-2 pode causar problemas neurológicos, como perda de olfato, dores de cabeça e "fog cerebral". No entanto, ainda é controverso se esses sintomas são causados pelo vírus que entra no cérebro ou se os sintomas são causados por sinais químicos liberados no cérebro pelo sistema imunológico em resposta ao vírus. Na doença de Parkinson, uma proteína chamada α-sinucleína forma fibrilas amiloides anormais, levando à morte dos neurônios produtores de dopamina no cérebro.
Curiosamente, a perda do olfato é um sintoma pré-motor comum na doença de Parkinson. Esse fato, bem como relatos de casos de Parkinson em pacientes com covid-19, fez com que Christian Blum, Mireille Claessens e colegas se perguntassem se os componentes proteicos do SARS-CoV-2 poderiam desencadear a agregação de α-sinucleína em amiloide. Eles escolheram estudar as duas proteínas mais abundantes do vírus: a proteína spike (S-), que ajuda o SARS-CoV-2 a entrar nas células, e a proteína nucleocapsid (N-), que encapsula o genoma de RNA dentro do vírus.
Em experimentos em tubo de ensaio, os pesquisadores usaram uma sonda fluorescente que liga fibrilas amiloides para mostrar que, na ausência das proteínas do coronavírus, a α-sinucleína exigia mais de 240 horas para se agregar em fibrilas. A adição da proteína S não teve efeito, mas a proteína N diminuiu o tempo de agregação para menos de 24 horas.
Em outros experimentos, a equipe mostrou que as proteínas N- e α-sinucleína interagem diretamente, em parte por meio de suas cargas eletrostáticas opostas, com pelo menos 3 ou 4 cópias de α-sinucleína ligadas a cada N-proteína. Em seguida, os pesquisadores injetaram proteína N e α-sinucleína marcada com fluorescência em um modelo de célula da doença de Parkinson, usando uma concentração semelhante de proteína N como seria esperado dentro de uma célula infectada por SARS-CoV-2.
Em comparação com células de controle com apenas α-sinucleína injetada, cerca de duas vezes mais células morreram após a injeção de ambas as proteínas. Além disso, a distribuição da α-sinucleína foi alterada nas células co-injetadas com ambas as proteínas, e estruturas alongadas foram observadas, embora os pesquisadores não pudessem confirmar que eram amiloides. Não se sabe se essas interações também ocorrem dentro dos neurônios do cérebro humano, mas se assim for, elas podem ajudar a explicar a possível ligação entre a infecção por covid-19 e a doença de Parkinson, dizem os pesquisadores. Fonte: Aventuras na Historia.
Tudo tem lógica, mas eu aguardaria mais um tempo para dar o diagnóstico de parkinson.