SEPTEMBER 30, 2020 - Parkinson’s drug Sifrol turns man into sex and gambling addict. Assista vídeo, na fonte. Leia mais sobre o tema AQUI.
Objetivo: atualização nos dispositivos de “Deep Brain Stimulation” aplicáveis ao parkinson. Abordamos critérios de elegibilidade (devo ou não devo fazer? qual a época adequada?) e inovações como DBS adaptativo (aDBS). Atenção: a partir de maio/20 fui impedido arbitrariamente de compartilhar postagens com o facebook. Com isto este presente blog substituirá o doencadeparkinson PONTO blogspot.com, abrangendo a doença de forma geral.
quarta-feira, 30 de setembro de 2020
Encontrando o equilíbrio certo de medicamentos para pacientes com Parkinson
SEPTEMBER 29, 2020 - Finding right drug balance for Parkinson's patients. Veja mais aqui: Novel Study Examines Optimal Drug Balance for Patients With Parkinson Disease.
terça-feira, 29 de setembro de 2020
segunda-feira, 28 de setembro de 2020
Os sintomas de Parkinson são a única maneira de diagnosticá-lo. Mas não por muito tempo.
Os médicos contam com os sintomas visíveis do Parkinson para diagnosticar a doença - descartando o diagnóstico precoce. Novas pesquisas apontam para um caminho mais rápido.
270920 - Os pesquisadores descobriram uma nova maneira de diagnosticar e monitorar a progressão da doença de Parkinson - mesmo antes do aparecimento dos primeiros sintomas da doença.
Por que isso é importante
Atualmente, os médicos diagnosticam a doença de Parkinson depois que os sintomas ocorrem. Nesse momento, pode haver danos significativos aos neurônios em algumas áreas do cérebro. O diagnóstico precoce significa que as pessoas que vivem com a doença de Parkinson podem ter uma melhor qualidade de vida e economizar em tratamentos caros.
Existe uma ampla gama de doenças neurodegenerativas que são difíceis ou impossíveis de diagnosticar antes que os sintomas ocorram. Este estudo também pode fornecer novas maneiras para os pesquisadores rastrearem moléculas que podem levar ao diagnóstico precoce de outras doenças como o Parkinson.
Os sintomas da doença de Parkinson são uma ferramenta de diagnóstico limitada
Atualmente, não existem testes específicos para o diagnóstico da doença de Parkinson. Os neurologistas procuram sintomas comuns do Parkinson, como tremores ou alterações na fala, e podem usar exames de sangue ou testes genéticos para descartar outras condições que causam sintomas semelhantes. Mas o diagnóstico da doença de Parkinson sempre ocorre depois que o paciente já apresenta os sintomas.
200.000 pessoas são diagnosticadas com Parkinson nos EUA a cada ano. Os médicos têm procurado novas maneiras de reconhecer a condição mais cedo, procurando por moléculas biológicas presentes antes que os sintomas do Parkinson se tornem visíveis. Por exemplo, aglomerados de proteína alfa-sinucleína comumente se formam no cérebro antes que os sinais externos da doença apareçam. Mas não existe uma maneira confiável de reconhecê-los e rastreá-los.
A tomografia por emissão de pósitrons (PET) é uma técnica de imagem que ajuda os médicos a ver o interior do corpo. Ele usa moléculas radioativas como traçadores para imagens de diferentes tecidos. Durante anos, uma equipe da Universidade da Pensilvânia trabalhou para encontrar um traçador que acendesse a alfa-sinucleína, a proteína característica do Parkinson. Se eles pudessem encontrar um traçador seletivo para identificar a proteína, os médicos poderiam usá-lo para diagnosticar a doença com um PET scan, possivelmente antes que o paciente experimentasse os sintomas debilitantes do Parkinson.
Agora, em um estudo publicado na Chemical Science, os pesquisadores descrevem uma nova maneira de identificar essas moléculas.
Como encontrar uma agulha em um palheiro
Quando os pesquisadores descreveram e publicaram a estrutura da alfa-sinucleína, a equipe foi finalmente capaz de confirmar experimentalmente onde as moléculas traçadoras poderiam se ligar à proteína. Usando um método de computação, eles examinaram milhões de moléculas candidatas para ver quais poderiam se ligar à proteína. Eles compararam os resultados de suas moléculas hipotéticas com as moléculas disponíveis comercialmente para encontrar aquelas com uma estrutura semelhante para restringir sua lista.
Eles começaram o processo com 7 milhões de compostos potenciais, reduziram-no a 20 candidatos promissores que poderiam testar em laboratório e, finalmente, encontraram dois que tinham uma alta taxa de ligação à alfa-sinucleína.
Essa prova de conceito para o processo permitirá que eles projetem e descubram rapidamente moléculas para outros distúrbios neurodegenerativos.
"Isso pode levar de 10 a 15 anos na indústria, e estamos tentando fazer isso em cerca de cinco", diz o químico E. James Petersson, principal autor do estudo.
"Eu realmente vejo isso como uma virada de jogo em como fazemos o desenvolvimento de sondas PET", disse o pesquisador Robert Mach. "O significado é que somos capazes de rastrear milhões de compostos em um período muito curto de tempo, e somos capazes de identificar um grande número de compostos que provavelmente se ligarão com alta afinidade à alfa-sinucleína." Original em inglês, tradução Google, revisão Hugo. Fonte: Freethink.
sábado, 26 de setembro de 2020
Ingrediente da cannabis demonstrou atuar contra os sintomas de Parkinson
26. September 2020 - Estudo prova a eficácia da cannabis na doença de Parkinson
Em um estudo recente, a eficácia de um canabinoide nos sintomas de Parkinson foi examinada pela primeira vez. Isso mostrou uma melhora demonstrável nos sintomas. O ingrediente ativo da cannabis já aprovado, nabilona, é, portanto, uma nova terapia potencial para o alívio da doença de Parkinson não motora.
Pesquisadores da Innsbruck University Clinic for Neurology examinaram a eficácia do canabinoide nabilona, que é aprovado para náusea induzida por quimioterapia, na doença de Parkinson. Verificou-se que o ingrediente ativo da cannabis alivia principalmente os sintomas não motores, como ansiedade e distúrbios do sono, que costumam ocorrer na doença de Parkinson. Os resultados da pesquisa foram apresentados na renomada revista "Annals of Neurology".
Sintomas não motores na doença de Parkinson
A doença de Parkinson é freqüentemente acompanhada pelos chamados sintomas não motores (SNM). Estes incluem, por exemplo, distúrbios funcionais do sistema nervoso autônomo, distúrbios de odor, alterações de humor, distúrbios de controle de impulso, comprometimento do desempenho cognitivo, distúrbios de percepção e alucinações. Além disso, a doença de Parkinson costuma causar distúrbios do sono, como insônia, sonolência diurna ou distúrbios do sono com sonhos (distúrbio de comportamento do sono REM).
Apenas algumas opções de terapia para NMS
“Muitos deles podem antecipar os sintomas motores típicos da doença de Parkinson em anos ou mesmo décadas”, explica o neurologista e autor do estudo correspondente, Klaus Seppi. A carga de NMS geralmente aumenta à medida que a doença progride. No entanto, até agora há poucos dados de estudos clínicos controlados sobre o tratamento dessas queixas. “As opções de tratamento disponíveis são limitadas ou os resultados muitas vezes insatisfatórios”, enfatiza Seppi.
A maconha já é considerada um "remédio caseiro" para o Parkinson
A eficácia da cannabis para aliviar essas doenças parece ter circulado entre os portadores de Parkinson. "O potencial efeito terapêutico dos canabinóides nas habilidades motoras e NMS na doença de Parkinson é um tópico importante e é frequentemente abordado pelos pacientes na sala de tratamento", relata a autora principal Marina Peball. Uma pesquisa mostrou que 95 por cento dos médicos que tratam do Parkinson já haviam sido solicitados a prescrever maconha medicinal.
Primeiros dados confiáveis sobre eficácia
Até agora, entretanto, não houve evidência suficiente de sua eficácia. Os estudos disponíveis eram muito pequenos ou não controlados. Por esta razão, o grupo de trabalho de Innsbruck decidiu realizar um estudo robusto. “Em nosso estudo, randomizamos, duplo-cego e placebo-controlado o efeito da nabilona no tratamento controlado da SNM na doença de Parkinson em um grande número de pacientes”, enfatiza Seppi.
O que é nabilona?
O canabinoide nabilona foi usado no estudo. O ingrediente ativo sintético é semelhante ao tetrahidrocanabinol (componente psicoativo da planta de cannabis). As propriedades farmacológicas também são semelhantes na contraparte sintética. "Decidimos conduzir este estudo com nabilona porque seu fabricante AOP Orphan forneceu a droga e o placebo associado", diz Seppi. Outras preparações à base de cannabis também teriam sido possíveis.
Prova de eficácia da cannabis no Parkinson pela primeira vez
"Nossos resultados mostram uma melhora na exposição geral à NMS com nabilona, o que se reflete, em particular, na redução da ansiedade e dos distúrbios do sono", concluem os pesquisadores. O tratamento foi geralmente bem tolerado.
Equipe de pesquisa recomenda cannabis para o tratamento de Parkinson
"Dados os dados e possíveis mecanismos de ação, podemos dizer que a nabilona parece melhorar os sintomas não motores em pacientes com Parkinson", conclui a equipe. O estudo atual, portanto, complementa a evidência anteriormente limitada sobre a eficácia dos tratamentos à base de cannabis em pessoas com doença de Parkinson com NMS. Original em alemão, tradução Google, revisão Hugo. Fonte: Heilpraxisnet.
Avanços na estimulação cerebral profunda para a doença de Parkinson
September 25, 2020 - Quase 1 milhão de pessoas nos EUA têm doença de Parkinson. Esse distúrbio do movimento afeta muitos aspectos do sistema nervoso, incluindo células cerebrais produtoras de dopamina em uma parte específica do cérebro. Como resultado, a falta ou níveis baixos de dopamina (um neurotransmissor que envia sinais entre as células cerebrais) podem causar sintomas como tremores, lentidão de movimento ou rigidez.
A maioria das pessoas que vivem com Parkinson tem excelente controle dos sintomas por vários anos com medicamentos que são convertidos em dopamina quando passam para o cérebro. No entanto, com a progressão da doença, o controle dos sintomas com medicamentos pode se tornar difícil para algumas pessoas. Para alguns, a estimulação cerebral profunda (DBS) pode ser uma opção.
O neurologista Jeff Bronstein, MD, PhD, que dirige o Programa de Distúrbios do Movimento na UCLA Health, oferece insights sobre DBS para Parkinson, incluindo avanços recentes:
O que é DBS?
A estimulação cerebral profunda envolve a implantação cirúrgica de fios em partes específicas do cérebro. Os fios enviam impulsos elétricos de alta frequência para bloquear os sinais defeituosos que causam os sintomas de Parkinson. A estimulação é programada por médicos, mas os pacientes também têm algum controle dentro de certos parâmetros.
“Remédios não perdem eficácia. Mas, à medida que o Parkinson progride, pode ser cada vez mais difícil ajustar a medicação”, disse o Dr. Bronstein. “Quando as pessoas precisam tomar seus comprimidos com frequência e ainda não têm controle dos sintomas ou efeitos colaterais indesejados, é hora de considerar o DBS.”
Dr. Bronstein adverte que o DBS não retarda a progressão da doença; no entanto, traz algum alívio na forma de:
Menos tremores e movimentos involuntários reduzidos (discinesia)
Rigidez reduzida (rigidez)
Diminuição da lentidão do movimento
“O DBS não é para todos - as pessoas precisam pesar o quanto os sintomas do Parkinson estão afetando sua qualidade de vida”, diz o Dr. Bronstein. “Como acontece com qualquer terapia, eles têm que decidir se o benefício supera os riscos mínimos que vêm com o DBS. Seu cirurgião falará sobre todos os benefícios e riscos potenciais.”
Como o DBS para Parkinson tem avançado nos últimos anos?
Embora o DBS já exista há mais de duas décadas, novos dispositivos surgiram no mercado que oferecem:
Um controlador aprimorado e amigável para o paciente
Recursos de programação sem contato usando conectividade do tipo Bluetooth
Menos efeitos colaterais transitórios de estimulação, como formigamento, tontura e visão dupla
A capacidade de registrar a atividade cerebral
“Cada eletrodo implantado no cérebro tem quatro contatos (conexões elétricas) que podemos ativar para determinar quais regiões do cérebro são estimuladas e em quanto”, diz o Dr. Bronstein. “Antes, o contato era um anel circular, que estimulava igualmente em todas as direções. Os novos aparelhos são segmentados para que possamos estimular em diferentes direções. Isso nos permite minimizar os efeitos colaterais e otimizar os benefícios.”
O próximo grande avanço - um sistema DBS de loop fechado - provavelmente virá em breve e poderá usar o recurso de gravação já disponível atualmente em um dos dispositivos. Dr. Bronstein explica: “Agora, nós programamos o sistema para estimular continuamente; podemos fazer o ajuste fino apenas ajustando a velocidade e a potência. Mas as pessoas podem não precisar de estimulação constante. Com um sistema de circuito fechado, podemos ler a atividade do cérebro para determinar quanta estimulação é necessária a qualquer momento. O recurso de gravação nos permite ajustar a estimulação com base na atividade cerebral real.”
Visão geral da cirurgia de Parkinson
Se você esgotou a terapia médica e ainda apresenta sintomas incapacitantes de Parkinson, pode valer a pena considerar o DBS, que é coberto pelo Medicare e pela maioria dos planos de seguro. Você receberá os melhores resultados e cuidados quando for tratado por um programa abrangente de distúrbios do movimento. Esses programas oferecem especialistas em distúrbios do movimento altamente treinados, neuropsicólogos e neurocirurgiões treinados em DBS. Seu time:
Discute os riscos e benefícios da cirurgia DBS para que você possa tomar uma decisão informada
Realiza exames detalhados com e sem medicamentos, incluindo ressonâncias magnéticas e análises de sangue
Se você decidir que DBS é certo para você, há duas fases de tratamento:
Fase um
Você ficará sob anestesia durante a maior parte da cirurgia inicial. Seu cirurgião:
Faz dois pequenos orifícios no couro cabeludo, um de cada lado do cérebro
Coloca condutores elétricos no cérebro
Interrompe a anestesia e, em seguida, acorda você e executa estímulos de teste indolores para garantir que os eletrodos estejam na região direita do cérebro
Coloca eletrodos sob a pele no couro cabeludo até o pescoço
A recuperação no hospital geralmente leva cerca de uma noite. Você pode ter uma leve dor de cabeça que deve aliviar com analgésicos não prescritos.
Fase dois
Duas semanas após a cirurgia, você terá um dispositivo de marca-passo implantado sob a pele em seu peito. Um cirurgião conecta o dispositivo aos fios em seu pescoço. Você fica sedado durante este procedimento ambulatorial e volta para casa no mesmo dia. Na semana seguinte, você retorna à clínica para iniciar a programação.
“Pode levar de dois a seis meses para encontrar as configurações ideais, mas a melhora geralmente começa no primeiro dia, com a primeira configuração”, diz Dr. Bronstein. “Como os dispositivos mais novos têm muitas configurações e uma interface amigável, podemos fazer muita programação por meio da telemedicina.”
O Programa de Distúrbios do Movimento da UCLA Health é um dos mais antigos do país. O programa recentemente adicionou provedores para melhorar o acesso de pacientes que precisam de tratamento para Parkinson. Original em inglês, tradução Google, revisão Hugo. Fonte: UCLAHealth.
Cannabis e doença de Parkinson - Nova declaração de consenso ajuda a orientar médicos e pacientes
September 22, 2020 — O uso de cannabis pode levantar questões complexas para pacientes com doença de Parkinson, incluindo possíveis efeitos adversos, toxicidade e interações medicamentosas.
Poucos estudos mostraram os benefícios ou malefícios da cannabis medicinal na doença de Parkinson, disse Benzi Kluger, MD, MS, do University of Rochester Medical Center, em Nova York.
Quatro pequenos ensaios randomizados de canabinóides foram conduzidos em pacientes com Parkinson com resultados mistos. "Esses testes foram pequenos, curtos e tiveram outras deficiências que tornam mais seguro considerá-los inconclusivos em vez de negativos", disse Kluger.
"Sabemos de alguns efeitos colaterais - como hipotensão, apatia e confusão - mas não sabemos se há algum efeito de longo prazo", acrescentou.
Mas o conhecimento sobre a ciência básica dos canabinoides e do sistema endocanabinoide está se expandindo, observou Kluger. "A literatura apóia fortemente um papel do sistema endocanabinoide no movimento normal e um papel potencial em muitos distúrbios do movimento."
"Existem alguns dados em modelos animais e séries de casos não controlados em pessoas para apoiar o potencial terapêutico dos canabinoides na doença de Parkinson, mas atualmente não temos ensaios clínicos randomizados que apoiem sua eficácia para sintomas motores ou não motores em pessoas que vivem com Parkinson," ele disse.
Em 2014, um comitê de diretrizes da Academia Americana de Neurologia (AAN) concluiu que o extrato de cannabis oral era "provavelmente ineficaz" para o tratamento de pacientes com Parkinson com discinesia.
Mais recentemente, a AAN publicou uma declaração de posição sobre a maconha medicinal, apoiando a pesquisa acadêmica e o reescalonamento da Drug Enforcement Administration para tornar os estudos mais fáceis de conduzir. A academia não apóia a legalização da maconha porque mais pesquisas sobre segurança e eficácia são necessárias, mas reconhece que a maconha medicinal pode ser útil para algumas condições neurológicas.
Em sua revisão mais recente dos tratamentos de Parkinson, a Movement Disorders Society também observou que as terapias à base de cannabis estavam cada vez mais sendo exploradas por pacientes para sintomas motores e não motores, mas poucos estudos randomizados preencheram os critérios da medicina baseada em evidências. “Há uma necessidade clara de ensaios clínicos randomizados de alta qualidade para avaliar a eficácia e, tão importante, a segurança na doença de Parkinson”, observou a sociedade.
Uso de cannabis comum na doença de Parkinson
Quase uma em cada quatro pessoas com doença de Parkinson usou cannabis recentemente, de acordo com dados de pesquisas com pacientes.
Os resultados da pesquisa, apresentados no Congresso Virtual da Sociedade de Distúrbios do Movimento 2020 e publicados no servidor de pré-impressão medRxiv, mostraram que 24,5% dos pacientes com Parkinson relataram usar cannabis nos últimos 6 meses.
Um total de 1.064 pacientes com Parkinson responderam à pesquisa online em janeiro de 2020, disse James Beck, PhD, diretor científico da Fundação de Parkinson em Nova York, e co-autores. Os participantes da pesquisa tinham uma idade média de 71 anos e a maioria eram homens.
Os usuários de cannabis eram mais propensos a relatar controle insuficiente de seus sintomas não motores de Parkinson com medicamentos prescritos do que os não usuários (P <0,005). Eles usaram cannabis para tratar sintomas como ansiedade (45,5%), dor (44,0%) e distúrbios do sono (44,0%).
No entanto, 23,0% também relataram que haviam parado de usar cannabis nos últimos 6 meses, em grande parte devido à falta de melhora dos sintomas (35,5%). E dos entrevistados da pesquisa que não usaram cannabis, a maioria disse que era porque havia uma falta de evidências científicas que sustentassem sua eficácia (59,9%).
"Descobrimos que a maioria das pessoas que vivem com a doença de Parkinson e usam cannabis o fazem sem ter recebido informações ou recomendações do fornecedor", observaram os pesquisadores. "Isso não foi totalmente surpreendente; um estudo anterior descobriu uma lacuna de conhecimento significativa sobre a maconha entre os clínicos especializados em doença de Parkinson, que se compara à nossa lacuna de conhecimento observada em pessoas com doença de Parkinson."
Uma nova declaração de consenso
Para ajudar a resolver essa lacuna de conhecimento, a Fundação de Parkinson reuniu pesquisadores, médicos e outros especialistas para criar a primeira declaração de consenso sobre a cannabis medicinal e a doença de Parkinson, emitida em maio de 2020.
"Os objetivos da declaração de consenso são orientar melhor as pessoas com Parkinson e seus médicos para ajudar a garantir o uso seguro da cannabis medicinal para os sintomas da doença de Parkinson", disse Beck.
“Nós entendemos da comunidade da doença de Parkinson que este é um tópico sobre o qual eles desejam saber mais, mas há informações muito limitadas disponíveis em que eles possam confiar”, acrescentou. “Esperamos preencher uma lacuna e entender melhor as implicações do uso de cannabis medicinal para os sintomas da doença de Parkinson em geral”.
A orientação descreve os produtos de cannabis, as evidências até o momento, os benefícios da cannabis, efeitos adversos e questões de segurança. A orientação aconselha os pacientes com Parkinson que desejam usar cannabis medicinal a:
Discuta qualquer uso de produtos canabinoides e possíveis interações medicamentosas com os médicos
Comece com doses baixas e aumente gradualmente
Esteja ciente dos efeitos colaterais potenciais, especialmente tonturas, problemas de equilíbrio, piora da motivação, boca seca e cognição prejudicada
A declaração de consenso não é um endosso à cannabis, Beck enfatizou.
"Não podemos apoiar o uso de cannabis medicinal até que tenhamos estudos de pesquisa mais confiáveis e uma melhor compreensão de seu impacto nas pessoas com Parkinson", disse ele. "Mais pesquisas sobre a cannabis medicinal são necessárias para determinar se seu uso pode ter efeitos positivos ou adversos para os sintomas da doença de Parkinson."
"Há muito trabalho a ser feito antes que possamos recomendar canabinóides com confiança para qualquer sintoma da doença de Parkinson", observou Kluger. “Embora existam estudos em animais sugerindo efeitos neuroprotetores, não temos evidências em pessoas que recomendem canabinóides para esse propósito”.
No entanto, muitas pessoas com doença de Parkinson querem experimentar cannabis. Esses pacientes precisam envolver seu médico, serem cautelosos e "ficarem com um único dispensário ou produto, já que a cannabis não é regulamentada e a rotulagem pode ser imprecisa", disse Kluger. Original em inglês, tradução Google, revisão Hugo. Fonte: MedPageToday.
sexta-feira, 25 de setembro de 2020
Coronavírus: cães farejadores usados para detectar vírus no aeroporto
25 Sep 2020 - Coronavirus: Sniffer dogs used to detect virus at airport. Mais acerca de cães, AQUI.
quinta-feira, 24 de setembro de 2020
A doença de Parkinson pode afetar os olhos - aqui está o que sabemos até agora
September 24, 2020 - A doença de Parkinson é a segunda doença neurodegenerativa mais comum, afetando mais de 10 milhões de pessoas em todo o mundo. É caracterizado por mudanças no movimento, incluindo tremores e movimentos mais lentos e rígidos. Mas os pesquisadores também estão começando a investigar outros sintomas da doença de Parkinson - incluindo aqueles que envolvem o olho.
O Parkinson resulta da degeneração dos neurônios da dopamina nos gânglios da base do cérebro - uma área envolvida no movimento voluntário. Embora não exista cura para o Parkinson, os sintomas podem ser controlados com drogas que substituem a dopamina.
Não existe um único teste de diagnóstico para Parkinson como a barreira hematoencefálica (que protege o cérebro de patógenos que vagam pela corrente sanguínea) e o crânio torna difícil avaliar o cérebro. Como resultado, avaliações subjetivas dos sintomas são usadas para diagnosticar os pacientes.
Dado que o Parkinson é conhecido por afetar o sistema motor do corpo, talvez não seja surpreendente que ele tenha demonstrado atrapalhar os movimentos dos olhos. De forma promissora, o Parkinson pode ser diagnosticado usando tecnologias que já existem, mostrando mudanças sutis nos movimentos dos olhos e o adelgaçamento de camadas específicas na retina. Isso pode ajudar a medir a eficácia dos tratamentos e determinar a progressão da doença.
Mudanças de movimento
Os estudos que investigam o efeito do Parkinson nos movimentos oculares têm se concentrado nos movimentos rápidos e balísticos de nossos olhos em direção a um estímulo (conhecido como sacadas). O oposto, antissaccades, são movimentos voluntários de nossos olhos se afastando de um estímulo. Os primeiros estudos mostraram que os erros em antissaccades - por meio dos quais os participantes não conseguiam desviar o olhar de um estímulo de luz - são maiores naqueles com Parkinson.
Outro estudo, que usou estimulação cerebral profunda, descobriu que o alvo do globus pallidus interna - a área do cérebro parcialmente responsável pelo movimento consciente - reduziu o número de erros antisaccade. A estimulação cerebral profunda é o único tratamento cirúrgico para a doença de Parkinson. Funciona direcionando eletricidade para regiões precisas do cérebro. A estimulação direcionada ao núcleo subtalâmico, uma região adjacente, não teve efeito. Recentemente, os pesquisadores descobriram que a estimulação do núcleo subtalâmico aumentava os erros antissaccade e atrasava tanto na direção quanto na direção do estímulo.
Embora as evidências do pequeno número de estudos de estimulação sejam conflitantes, eles destacam como a doença de Parkinson pode influenciar os movimentos dos olhos.
Um estudo do início deste ano descreve 85% dos pacientes recentemente diagnosticados com Parkinson exibindo vibração palpebral rítmica ao fechar os olhos. Essas pequenas mudanças no movimento podem ser medidas virtualmente por meio de webcams. No entanto, estudos maiores são necessários para investigar o potencial da vibração palpebral como ferramenta diagnóstica.
Afinamento da retina
Os pesquisadores identificaram o acúmulo anormal da proteína alfa-sinucleína em áreas do cérebro envolvidas com o movimento voluntário em pacientes com doença de Parkinson. A alfa-sinucleína é encontrada em todo o cérebro, embora sua função ainda não esteja bem definida. Acredita-se que ele regule a síntese de dopamina, que por sua vez ajuda a regular o movimento.
Curiosamente, vários estudos recentes encontraram um acúmulo de alfa-sinucleína no tecido retinal de pacientes com Parkinson em comparação com amostras saudáveis. A quantidade de alfa-sinucleína encontrada pode até mesmo se correlacionar com a gravidade da doença - embora este indicador potencial de doença só possa ser detectado usando amostras de tecido post-mortem.
Varreduras de tomografia de coerência óptica (OCT), que capturam imagens transversais das dez camadas distintas da retina, podem permitir que os pesquisadores detectem alterações na retina em pacientes vivos. Esses exames são rápidos, não invasivos, relativamente baratos e fáceis de usar.
Uma série de estudos OCT mostraram até agora afinamento da retina em pacientes com Parkinson. Não são apenas neurônios de dopamina encontrados em regiões específicas da retina, as camadas da retina vizinhas a essas regiões foram encontradas para abrigar alfa-sinucleína. Estudos mostram que o afinamento da retina ocorre seletivamente nessas camadas da retina, potencialmente indicando o início da doença de Parkinson precoce.
O homem tem seus olhos testados usando uma máquina de OCT.
As varreduras de OCT podem mostrar afinamento das camadas retinais. Parilov / Shutterstock
Juntamente com o diagnóstico de Parkinson, os testes oculares também podem ajudar a monitorar a progressão da doença. Um estudo envolvendo 126 participantes procurou ver se as varreduras de OCT e testes de gráfico visual simples em pacientes com doença de Parkinson se correlacionavam com o risco de demência (um algoritmo foi usado para calcular o risco).
Aqueles com doença de Parkinson que foram calculados como tendo o maior risco de demência se saíram pior nos testes de visão. Esses pacientes também apresentaram maior afinamento da retina. Essas descobertas não foram replicadas em participantes que tinham um risco de demência igualmente alto, mas nenhum diagnóstico de Parkinson.
No entanto, esse tipo de estudo apresenta limitações. O número de pacientes envolvidos e outros fatores - como a medicação que tomam - podem afetar os resultados. Os exames oftalmológicos também são mais difíceis de realizar em pacientes com os sintomas mais graves.
Big data
À medida que mais pacientes são estudados, mais pode ser aprendido sobre a doença de Parkinson. Os estudos de big data podem ser vantajosos porque a doença de Parkinson é relativamente comum e as varreduras oculares estão se tornando cada vez mais rotineiras. Isso permite que os pesquisadores analisem um grande número de varreduras de OCT e imagens da retina já capturadas em pacientes com e sem Parkinson.
Existem bancos de dados como este, sendo o maior o INSIGHT Data Hub for Eye Health, que consiste em milhões de exames oculares juntamente com históricos médicos anônimos de mais de 250.000 pacientes. Abordagens baseadas na população, juntamente com o uso de aprendizado de máquina (um tipo de inteligência artificial) e aprendizado profundo (um subconjunto do aprendizado de máquina), podem vasculhar grandes bancos de dados, descobrindo padrões. Os pesquisadores podem usar vários exames de olho do mesmo paciente para ajudar a investigar a progressão da doença.
Um crescente corpo de evidências sugere que as mudanças nos movimentos dos olhos e na estrutura da retina resultam da degeneração da dopamina, que é característica da doença de Parkinson. Outros distúrbios visuais, como mudanças no movimento rápido dos olhos durante o sono, percepção de movimento e visão de cores, também estão sob investigação. É importante ressaltar que essas alterações podem ser detectadas de forma não invasiva. Original em inglês, tradução Google, revisão Hugo. Fonte: The Conversation.
Israel registra 1º possível caso de Parkinson relacionado à Covid-19
Paciente de 45 anos desenvolveu sintomas da doença após se curar da Covid-19; cientistas se preocupam com uma possível onda de doenças neurodegenerativas
23/09/2020 - Médicos do Hospital Universitário Samson Assuta Ashdod, em Israel, relataram o caso de um paciente de 45 anos que passou a apresentar sintomas relacionados à doença de Parkinson após se curar da Covid-19.
O homem foi hospitalizado com o novo coronavírus no dia 17 de março, dias após retornar de uma viagem aos Estados Unidos. Semanas depois, quando os exames RT-PCR já apontavam resultado negativo para a doença, ele passou a relatar tremores e dificuldades para escrever e falar.
A manifestação desses sintomas levaram o paciente a ser internado no Departamento de Neurologia do hospital. Lá, exames confirmaram uma alteração em neurônios dopaminérgicos, que produzem dopamina.
O quadro se agravou desde então, e, de acordo com os profissionais de saúde responsáveis pelo caso, o homem agora tem expressão facial reduzida e tremores extremos no lado direito do corpo.
O relato foi enviado para publicação na próxima edição da revista The Lancet, especializada em temas ligados à medicina. É importante frisar que não se trata de uma pesquisa científica, mas da observação de um único paciente.
Não é possível, ainda, afirmar se o desenvolvimento da doença de Parkinson tem ligação concreta com o diagnóstico prévio de Covid-19. No entanto, os cientistas sublinham que o paciente não possui histórico familiar do distúrbio ou "qualquer outro fator de risco evidente", como observa a Galileu.
Parkinson: a "terceira onda" da pandemia?
Estudos anteriores já haviam demonstrado que o Sars-Cov-2 pode ocasionar danos cerebrais, sintomas neurológicos e perda de memória, mas não está claro de que forma o vírus age para causar esses efeitos.
De acordo com o neurocientista australiano Kevin Barnham, do Florey Institute of Neuroscience & Mental Health, a hipótese mais aceita é a de que o vírus pode danificar parte das células do cérebro, tendo potencial para levar à neurodegeneração em algum nível.
Barnham é coautor de um estudo que aponta que a pandemia de Covid-19 pode ter uma "terceira onda" não mais relacionada a reinfecções pelo novo coronavírus, mas a um aumento de casos da doença de Parkinson associados ao Sars-Cov-2.
À Science Alert, o neurocientista afirmou que algo parecido ocorreu após a pandemia de gripe espanhola, no início do século passado, quando uma forma de inflamação no cérebro chamada encefalite letárgica passou a atingir as pessoas que haviam se curado da doença.
Atualmente, não há dados suficientes para constatar a relação entre condições neurológicas e a Covid-19. Por isso, Barnham sugere que as autoridades de saúde não ajam somente para prevenir a doença, mas realizem também um rastreamento de longo prazo dos casos recuperados, monitorando a manifestação de distúrbios neurodegenerativos. Fonte: Olhar Digital.
quarta-feira, 23 de setembro de 2020
Consequências neurológicas de COVID-19: a "onda silenciosa"
22 September 2020 - Mebourne, Austrália - O mundo está preparado para uma onda de consequências neurológicas que podem estar a caminho como resultado do COVID-19? Esta questão está na vanguarda das pesquisas em andamento no Florey Institute of Neuroscience and Mental Health. Uma equipe de neurocientistas e médicos está examinando a ligação potencial entre COVID-19 e o aumento do risco de doença de Parkinson, e medidas para ficar à frente da curva.
"Embora os cientistas ainda estejam aprendendo como o vírus SARS-CoV-2 é capaz de invadir o cérebro e o sistema nervoso central, o fato de que está entrando é claro. Nosso melhor entendimento é que o vírus pode causar insultos às células cerebrais, com potencial para neurodegeneração seguir em frente a partir daí", disse o professor Kevin Barnham do Florey Institute of Neuroscience & Mental Health.
Em um artigo de revisão publicado hoje no Journal of Parkinson's Disease, os pesquisadores destacaram as potenciais consequências neurológicas de longo prazo do COVID-19, apelidando-o de "onda silenciosa". Eles estão pedindo uma ação urgente para ter ferramentas de diagnóstico mais precisas disponíveis para identificar a neurodegeneração precocemente e uma abordagem de monitoramento de longo prazo para pessoas que foram infectadas com o vírus SARS-CoV-2.
Os pesquisadores relatam que os sintomas neurológicos em pessoas infectadas com o vírus variam de graves, como hipóxia cerebral (falta de oxigênio), a sintomas mais comuns, como perda do olfato.
"Descobrimos que a perda ou redução do olfato foi, em média, relatada em três em cada quatro pessoas infectadas com o vírus SARS-CoV-2. Embora na superfície esse sintoma possa parecer pouco motivo de preocupação, na verdade ele nos diz muito sobre o que está acontecendo por dentro e que há uma inflamação aguda no sistema olfatório responsável pelo cheiro ”, explicou a pesquisadora da Florey Leah Beauchamp.
A inflamação é conhecida por desempenhar um papel importante na patogênese da doença neurogerativa e tem sido particularmente bem estudada na doença de Parkinson. Pesquisas adicionais sobre essas doenças podem ser críticas para os impactos futuros do SARS-CoV-2.
"Acreditamos que a perda do olfato representa uma nova maneira de detectar o risco de alguém desenvolver a doença de Parkinson precocemente. Armado com o conhecimento de que a perda do olfato está presente em cerca de 90% das pessoas nos estágios iniciais da doença de Parkinson e uma década antes do motor sintomas, sentimos que estamos no caminho certo ", acrescentou Beauchamp.
O diagnóstico clínico da doença de Parkinson atualmente depende da apresentação de disfunção motora, mas a pesquisa mostra que a essa altura, 50-70% da perda de células de dopamina no cérebro já ocorreu.
"Ao esperar até este estágio da doença de Parkinson para diagnosticar e tratar, você já perdeu a janela para que as terapias neuroprotetoras tenham o efeito pretendido. Estamos falando de uma doença insidiosa que afeta 80.000 pessoas na Austrália, que deve dobrar até 2040 antes mesmo de considerar as consequências potenciais do COVID, e atualmente não temos terapias modificadoras da doença disponíveis ", disse o professor Barnham.
Os pesquisadores esperam estabelecer um protocolo de triagem simples e de baixo custo com o objetivo de identificar as pessoas na comunidade em risco de desenvolver o mal de Parkinson, ou que estão nos estágios iniciais da doença, em um momento em que as terapias têm o maior potencial para prevenir o aparecimento de doenças motoras. disfunção. Eles planejam apresentar a proposta de financiamento do esquema de financiamento futuro de pesquisa médica do governo australiano.
Além disso, a equipe desenvolveu duas terapias neuroprotetoras atualmente sob investigação e identificou uma coorte de indivíduos que são ideais para estudar os tratamentos. Por meio de sua pesquisa, eles obtiveram novas evidências de que as pessoas com transtorno de comportamento do sono REM têm uma predisposição maior para desenvolver a doença de Parkinson.
A doença de Parkinson é um fardo econômico significativo que custa à economia australiana mais de US $ 10 bilhões por ano.
“Temos que mudar o pensamento da comunidade de que o Parkinson não é uma doença da velhice. Como temos ouvido várias vezes, o coronavírus não discrimina - e nem o Parkinson”, disse o professor Barnham. "Podemos ter uma visão das consequências neurológicas que se seguiram à pandemia de gripe espanhola em 1918, onde o risco de desenvolver a doença de Parkinson aumentou de duas a três vezes. Considerando que a população mundial foi atingida novamente por uma pandemia viral, é realmente muito preocupante considerar o potencial aumento global de doenças neurológicas que poderiam se desdobrar no futuro. "
Ele acrescentou: "O mundo foi pego de surpresa pela primeira vez, mas não precisa ser novamente. Agora sabemos o que precisa ser feito. Junto com uma abordagem estratégica de saúde pública, ferramentas para diagnóstico precoce e melhores tratamentos estão em andamento para ser a chave.” Original em inglês, tradução Google, revisão Hugo. Fonte: Journal of Parkinsons Disease.
Especialistas alertam que o coronavírus pode causar 'onda' de condições neurológicas, incluindo doença de Parkinson
22092020 - Experts warn coronavirus may cause 'wave' of neurological conditions including Parkinson's disease.
Leia mais aqui (em inglês): Consequências neurológicas de COVID-19: a "onda silenciosa".
A doença de Parkinson não é uma, mas duas doenças
September 22, 2020 - Resumo:
Pesquisadores de todo o mundo ficaram intrigados com os diferentes sintomas e variadas vias de doença dos pacientes de Parkinson. Um grande estudo identificou agora que existem, na verdade, dois tipos da doença.
Embora o nome possa sugerir o contrário, a doença de Parkinson não é uma, mas duas doenças, começando no cérebro ou nos intestinos. O que explica porque os pacientes com Parkinson descrevem sintomas amplamente diferentes e aponta para a medicina personalizada como o caminho a seguir para as pessoas com doença de Parkinson.
Esta é a conclusão de um estudo que acaba de ser publicado na principal revista neurológica Brain.
Os pesquisadores por trás do estudo são o professor Per Borghammer e o médico Jacob Horsager, do Departamento de Medicina Clínica da Universidade de Aarhus e do Hospital Universitário de Aarhus, na Dinamarca.
"Com a ajuda de técnicas de varredura avançadas, mostramos que a doença de Parkinson pode ser dividida em duas variantes, que começam em locais diferentes do corpo. Para alguns pacientes, a doença começa nos intestinos e se espalha de lá para o cérebro por meio conexões neurais. Para outros, a doença começa no cérebro e se espalha para os intestinos e outros órgãos, como o coração", explica Per Borghammer.
Ele também destaca que a descoberta pode ser muito significativa para o tratamento da doença de Parkinson no futuro, pois deve se basear no padrão de doença de cada paciente.
A doença de Parkinson é caracterizada pela lenta deterioração do cérebro devido ao acúmulo de alfa-sinucleína, uma proteína que danifica as células nervosas. Isso leva a movimentos lentos e rígidos que muitas pessoas associam à doença.
No estudo, os pesquisadores usaram técnicas avançadas de PET e ressonância magnética para examinar pessoas com doença de Parkinson. Pessoas que ainda não foram diagnosticadas, mas apresentam alto risco de desenvolver a doença, também estão incluídas no estudo. Pessoas com diagnóstico de síndrome do comportamento do sono REM têm um risco aumentado de desenvolver a doença de Parkinson.
O estudo mostrou que alguns pacientes tiveram danos ao sistema dopaminérgico do cérebro antes de ocorrerem danos nos intestinos e no coração. Em outros pacientes, as varreduras revelaram danos ao sistema nervoso dos intestinos e do coração antes que o dano no sistema de dopamina do cérebro fosse visível.
Este conhecimento é importante e desafia a compreensão da doença de Parkinson que tem sido prevalente até agora, diz Per Borghammer.
"Até agora, muitas pessoas consideravam a doença relativamente homogênea e a definiam com base nos distúrbios clássicos do movimento. Mas, ao mesmo tempo, ficamos intrigados sobre por que havia uma diferença tão grande entre os sintomas dos pacientes. Com esse novo conhecimento, os diferentes sintomas fazem mais sentido e é também nessa perspectiva que as pesquisas futuras devem ser vistas”, afirma.
Os pesquisadores se referem aos dois tipos de doença de Parkinson como primeiro o corpo e o cérebro. No caso do corpo em primeiro lugar, pode ser particularmente interessante estudar a composição das bactérias nos intestinos, conhecida como microbiota.
"Já foi demonstrado que os pacientes com Parkinson têm um microbioma nos intestinos diferente do que as pessoas saudáveis, sem que realmente entendamos o significado disso. Agora que somos capazes de identificar os dois tipos de doença de Parkinson, podemos examinar o risco fatores e possíveis fatores genéticos que podem ser diferentes para os dois tipos. A próxima etapa é examinar se, por exemplo, a doença de Parkinson pode ser tratada tratando os intestinos com transplante de fezes ou de outras maneiras que afetam o microbioma ", diz Per Borghammer.
"A descoberta do Parkinson com o cérebro primeiro é um desafio maior. Esta variante da doença é provavelmente relativamente livre de sintomas até que os sintomas do distúrbio do movimento apareçam e o paciente seja diagnosticado com Parkinson. A essa altura, o paciente já perdeu mais da metade da sistema de dopamina e, portanto, será mais difícil encontrar pacientes com antecedência suficiente para ser capaz de retardar a doença ", diz Per Borghammer.
O estudo da Aarhus University é longitudinal, ou seja, os participantes são chamados novamente após três e seis anos para que todos os exames e varreduras possam ser repetidos. De acordo com Per Borghammer, isso torna o estudo o mais abrangente de todos os tempos e fornece aos pesquisadores conhecimento e esclarecimento valiosos sobre a doença de Parkinson - ou doenças.
"Estudos anteriores indicaram que poderia haver mais de um tipo de Parkinson, mas isso não foi demonstrado claramente até este estudo, que foi projetado especificamente para esclarecer essa questão. Agora temos conhecimentos que oferecem esperança para um tratamento melhor e mais direcionado de pessoas que serão afetadas pela doença de Parkinson no futuro ", diz Per Borghammer.
De acordo com a Associação Dinamarquesa da Doença de Parkinson, há 8.000 pessoas com doença de Parkinson na Dinamarca e até oito milhões de pacientes diagnosticados em todo o mundo.
Espera-se que esse número aumente para 15 milhões em 2050 devido ao envelhecimento da população, pois o risco de contrair a doença de Parkinson aumenta dramaticamente quanto mais velha a população se torna. Original em inglês, tradução Google, revisão Hugo. Fonte: Science Daily. Veja mais aqui: There may be more than one type of Parkinson's Disease.
terça-feira, 22 de setembro de 2020
Engenheiros conectam cérebros a computadores usando implantes impressos em 3-D.
SEPTEMBER 22, 2020 - Engineers link brains to computers using 3-D printed implants.
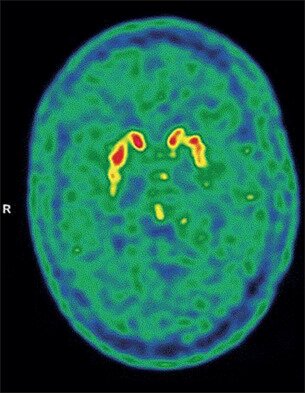
Pesquisadores desenvolvem em São Carlos eletrodos utilizados como biossensores para detecção precoce da doença de Parkinson
22 SET 2020 - A doença de Parkinson é uma doença degenerativa e progressiva de áreas específicas do cérebro, caracterizada pelo tremor dos músculos em repouso, pelo aumento no tônus muscular, instabilidade de movimentos e dificuldade de equilíbrio. Embora atualmente não exista cura para a doença, se descoberta precocemente, ela pode ser tratada de maneira eficaz, retardando a evolução dos sintomas. O desafio, no entanto, é que até o momento não há exames neurológicos e tomografias computadorizadas que demonstrem essas alterações físicas. Pensando na potencialidade dos marcadores biológicos auxiliarem a descoberta nos estágios iniciais de diversas doenças, os pesquisadores do Departamento de Ciências da Natureza, Matemática e Educação (DCNME) da Universidade Federal de São Carlos, Bruno Campos Janegitz, Gabriela Carolina Mauruto de Oliveira e Jeferson Henrique de Souza Carvalho, numa parceria com Laís Canniatti Braazaca, da Universidade de São Paulo (SP), e Nirton Cristi Silva Vieira da, Universidade Federal de São Paulo (Unifesp), desenvolveram uma tecnologia que determina dois biomarcadores - a dopamina e a proteína DJ1 - relacionadas com a doença de Parkinson.
A patente de invenção, intitulada "Eletrodos flexíveis de platina utilizados como biossensores eletroquímicos para determinação de biomarcadores relacionados à doença de Parkinson e método de fabricação", realiza a análise eletroquímica através da utilização da dopamina de uma amostra, inserindo-a no eletrodo e determinando a disfunção dos biomarcadores que significam que o paciente tem a predisposição de desenvolver o Parkinson. Isso acontece porque a proteína DJ1 atua no bloqueio da sinapse, e sua disfunção faz com que a estrutura física do paciente comece a tremer.
De acordo com dados da Organização Mundial da Saúde, de 2018, 1% da população mundial acima de 65 anos já convivia com a doença de Parkinson, sendo que, no Brasil, a estimativa é de que ela acometa mais de 200 mil pessoas. Considerando a expressividade destes números pouco explorados na literatura científica, o grupo liderado por Bruno Janegitz investiu em atuar na detecção de doenças autoimunes acreditando num mercado promissor de tratamento através da indústria farmacêutica. "A detecção de uma doença neurológica tão debilitante quanto a Doença de Alzheimer que leva o paciente à demência ainda é limitada", relata.
Levando cerca de um ano para ser desenvolvida - desde os testes preliminares em amostras sintéticas - durante a pesquisa de mestrado em Biotecnologia de Gabriela de Oliveira, os diferenciais desta tecnologia se referem à portabilidade, agilidade e sustentabilidade. "É um equipamento novo que pode ser levado e utilizado em qualquer hospital e laboratório de análises, levando cerca de 5 horas para oferecer o diagnóstico. Além disso, por se tratar de um filme de platina flexível, o sistema pode ser facilmente descartado", explicou Janegitz.
A tecnologia poderá interessar às indústrias farmacêuticas e laboratórios nacionais e internacionais, e foi recentemente publicada em revista de alto impacto e uma das mais importante na área de biossensores. Para estar disponível no mercado, no entanto, a tecnologia carece do interesse da indústria, além de incentivo governamental com impostos negociáveis a partir de seu licenciamento. O pesquisador acredita que o alinhamento do Governo poderia destravar a inovação no Brasil à medida que os empresários entendessem que diversas soluções podem ser desenvolvidas dentro das universidades, e produzidas em larga escala no Brasil, com baixo custo e fácil acesso. Nesse sentido, do ponto de vista sintético, todas as etapas foram realizadas em escala laboratorial, mas há a necessidade de realizar os testes clínicos com amostras de pacientes com a doença através de parcerias com hospitais e indústrias farmacêuticas ou médicas visando validar como os biomarcadores se manifestam.
O grupo já atua com produtos patenteados para detecção de proteínas para doenças neurológicas desde a pesquisa de doutorado de Janegitz. Neste momento, com apenas cinco anos de trabalho e diversas pesquisas na área da saúde, o grupo interrompeu suas atividades e redirecionou esforços para a Covid-19 em meio à pandemia mundial. Além de estudar o tema a fim de entender o percurso do vírus, eles reuniram outros pesquisadores de diferentes áreas e montaram grupos de trabalhos para submissão de projetos das agências de fomento à pesquisa. Segundo o pesquisador, no momento, o grupo atua em trabalho financiado pela Capes para a Covid-19, propondo estes mesmos sensores de platina flexíveis para a detecção do vírus em parceira com outros professores. "A tecnologia é tão abrangente que poderá ser testada para detecção de vírus, fungos, bactérias etc. para verificar a ligação do anticorpo relacionado a determinada doença no eletrodo, ou seja, podemos estender o procedimento da patente para qualquer patógeno".
Reconhecido o potencial direto da tecnologia, Janegitz evidencia a importância do trabalho realizado dentro das universidades e institutos de pesquisas para a produção de bens de consumo para a sociedade. "Sempre ressalto que sozinhos não fazemos absolutamente nada, pois são necessárias muitas ideias e discussões com parceiros e executores para que as coisas saiam do papel. Hoje, mais do que nunca, podemos dizer que a ciência é muito importante e a inovação pode gerar oportunidades incríveis de transformar a vida das pessoas", finalizou. Original em inglês, tradução Google, revisão Hugo. Fonte: São Carlos Agora.
segunda-feira, 21 de setembro de 2020
Pesquisadores descobrem novas moléculas para rastrear a doença de Parkinson
21092020 - Para qualquer um dos 200.000 pacientes diagnosticados com doença de Parkinson nos Estados Unidos a cada ano, o diagnóstico geralmente ocorre apenas após o aparecimento de sintomas graves, como tremores ou dificuldades de fala. Com o objetivo de reconhecer e tratar doenças neurológicas mais cedo, os pesquisadores estão procurando novas maneiras de criar imagens de moléculas biológicas que indiquem a progressão da doença antes que os sintomas apareçam. Um desses candidatos, e uma marca registrada conhecida da doença de Parkinson, é a formação de aglomerados de proteína alfa-sinucleína e, embora esta proteína tenha sido identificada há mais de 20 anos, uma maneira confiável de rastrear agregados de alfa-sinucleína no cérebro ainda a ser desenvolvido.
Agora, um novo estudo publicado na Chemical Science descreve uma abordagem inovadora para identificar moléculas que podem ajudar a monitorar a progressão da doença de Parkinson. Conduzido por pesquisadores nos laboratórios de E. James Petersson, Robert Mach e Virginia Lee, este estudo de prova de conceito pode mudar o paradigma de como os pesquisadores devem rastrear e testar novas moléculas para estudar uma ampla gama de doenças neurodegenerativas.
O estudo desses tipos de agregados de proteínas requer novos traçadores, moléculas radioativas que os médicos usam para criar imagens de tecidos e órgãos, para tomografia por emissão de pósitrons (PET). Como pesquisador sênior na área de desenvolvimento de traçadores PET, Mach e seu grupo trabalharam por vários anos com a Michael J. Fox Foundation para desenvolver um traçador alfa-sinucleína, mas sem dados sobre a estrutura da proteína, eles foram incapazes de encontrar candidatos que foram seletivos o suficiente para serem usados como uma ferramenta de diagnóstico.
Então, com a primeira publicação da estrutura da alfa-sinucleína e um aumento nas ferramentas disponíveis no campo da química computacional, Mach e Petersson começaram a colaborar no desenvolvimento de um traçador PET de alfa-sinucleína. Ao combinar seus respectivos conhecimentos em radioquímica e engenharia de proteínas, eles foram capazes de confirmar experimentalmente onde as moléculas traçadoras potenciais da proteína alfa-sinucleína eram capazes de se ligar, informações cruciais para ajudá-los a descobrir e projetar moléculas que seriam específicas para a alfa-sinucleína.
Em seu último estudo, os pesquisadores desenvolveram um método computacional de alto rendimento, permitindo-lhes rastrear milhões de moléculas candidatas, para ver quais se ligam aos sítios de ligação conhecidos na alfa-sinucleína. Construindo um método publicado anteriormente, sua abordagem primeiro identifica um "exemplar", uma pseudo-molécula que se encaixa perfeitamente no local de ligação da alfa-sinucleína. Então, esse exemplo é comparado a moléculas reais que estão comercialmente disponíveis para ver quais têm uma estrutura semelhante. Os pesquisadores então usam outros programas de computador para ajudar a restringir a lista de candidatos para teste no laboratório.
Para avaliar o desempenho de seu método de triagem, os cientistas identificaram um pequeno subconjunto de 20 candidatos promissores dos 7 milhões de compostos que foram selecionados e descobriram que dois tinham uma afinidade de ligação extremamente alta à alfa-sinucleína. Os pesquisadores também usaram tecidos cerebrais de camundongos fornecidos pelo grupo de Lee para validar ainda mais esse novo método. Os pesquisadores ficaram impressionados e agradavelmente surpresos com sua taxa de sucesso, que atribuem à natureza específica de seu método de pesquisa. “Certamente também há um pouco de sorte envolvida”, acrescenta Petersson, “Provavelmente a maior surpresa é como funcionou bem”.
A ideia de usar o método exemplar para resolver este problema veio ao primeiro autor e doutorado John "Jack" Ferrie, enquanto ele estava aprendendo métodos de química computacional no Instituto de Design de Proteínas da Universidade de Washington como parte de uma bolsa de verão da Fundação Parkinson. “A bolsa de verão foi projetada para treinar alunos em novos métodos que podem ser aplicados à pesquisa da doença de Parkinson, e foi exatamente isso o que aconteceu aqui”, diz Petersson. “As ideias que Jack trouxe formaram a base de um grande esforço em meu laboratório e no de Bob Mach para identificar rastreadores PET computacionalmente.”
Agora, como parte de uma grande doação multi-institucional, Petersson, Mach, Lee e muitos outros colaboradores estão prontos para aproveitar as lições aprendidas com essa descoberta para desenvolver rastreadores PET para Parkinson e outras doenças neurodegenerativas. “Eu realmente vejo isso como uma virada de jogo na forma como fazemos o desenvolvimento de sondas PET”, diz Mach. “O significado é que somos capazes de rastrear milhões de compostos em um período muito curto de tempo e podemos identificar um grande número de compostos que provavelmente se ligam com alta afinidade à alfa-sinucleína. Também vamos aplicar este mesmo método ao desenvolvimento de outras sondas que são importantes, mas apresentam desafios para o campo.”
Ao desenvolver ferramentas confiáveis de alto rendimento que usam um conhecimento detalhado da estrutura da proteína, o objetivo dos esforços futuros é encontrar novos candidatos a traçadores e levá-los à clínica assim que estiverem prontos para o teste. “Certamente é acelerado em comparação com o que é normal”, diz Petersson sobre os prazos da concessão. “Isso pode levar de 10 a 15 anos na indústria, e estamos tentando fazer isso em cerca de cinco.”
Mach acrescenta que esse esforço é um exemplo perfeito de “como as coisas funcionam aqui na Penn”, com sucesso possibilitado por colaborações entre pesquisadores com conjuntos de habilidades diversos e únicos. “Penn é um ótimo lugar porque você tem muitas pessoas talentosas que têm um verdadeiro espírito de colaboração, e isso é o que é preciso para fazer ciência nos dias de hoje”, diz ele. Original em inglês, tradução Google, revisão Hugo. Fonte: University of Pennsylvania.
Secreção de melatonina em pacientes com doença de Parkinson recebendo terapia com levodopa em diferentes doses
Sep 21, 2020 - A melatonina está envolvida na regulação do sono e na ritmicidade biológica circadiana; a diminuição da secreção de melatonina foi associada a perturbações circadianas. Estudos anteriores avaliando os níveis de melatonina entre pacientes com doença de Parkinson (DP) e controles sem DP encontraram resultados conflitantes; entretanto, estudos em larga escala não foram realizados. Nosso objetivo é comparar os níveis de melatonina endógena entre pacientes com doença de Parkinson (DP) e idosos sem DP.
Neste estudo transversal em 201 pacientes ambulatoriais com DP e 380 adultos idosos japoneses residentes na comunidade (controles), a excreção urinária de 6-sulfatoximelatonina foi medida para estimar os níveis de melatonina endógena.
A excreção urinária de 6-sulfatoximelatonina (UME) não diferiu significativamente em geral entre os pacientes com DP e os controles sem DP, mesmo após o ajuste para idade, sexo, medicamentos, hábitos de sono e estações do ano. Entre os pacientes com DP, uma associação de dose-resposta clara e robusta foi encontrada entre a dose equivalente de levodopa e UME, independente de fatores de confusão potenciais, incluindo a gravidade da doença de Parkinson. Em comparação com o grupo quartil de dose equivalente de levodopa mais baixa (dose equivalente de levodopa média, 132 mg / dia), o grupo mais alto (dose equivalente de levodopa média, 973 mg / dia) exibiu um aumento de 68% na UME (17,8 vs. 30,0 ng / mg cre, respectivamente). Além disso, em comparação com os controles não-DP, os pacientes com DP que receberam uma dose equivalente de levodopa mais baixa apresentaram UME diminuída e aqueles que receberam dose equivalente de levodopa mais alta exibiram UME aumentada.
Nosso estudo sugere que os níveis de melatonina em pacientes com DP que recebem doses médias de levodopa são comparáveis aos de adultos mais velhos, mesmo após considerar fatores de confusão. Essa associação foi modulada pela dose diária de levodopa em pacientes com DP. Original em inglês, tradução Google, revisão Hugo. Fonte: Physiciansweekly. Leia mais sobre a melatonina AQUI.
Um caso provável de doença de Parkinson após infecção com SARS-CoV-2
21 SEPTEMBRE 2020 - Un cas probable de maladie de Parkinson après infection par le SARS-CoV-2, veja mais AQUI.
Como o CBD pode ajudar a controlar os sintomas de Parkinson
20/09/2020 - Como o CBD pode ajudar a controlar os sintomas de Parkinson.
Esse componente da Cannabis prova ser uma alternativa muito mais segura em relação à medicina tradicional, sem efeitos colaterais prejudiciais
sábado, 19 de setembro de 2020
Atualização sobre as tecnologias atuais para estimulação cerebral profunda na doença de Parkinson
September 1, 2020 - Resumo - A estimulação cerebral profunda (DBS) está se tornando cada vez mais central no tratamento de pacientes com doença de Parkinson e outros distúrbios do movimento. Desenvolvimentos recentes no projeto do eletrodo DBS e do gerador de pulso implantável fornecem maior flexibilidade para a programação, melhorando potencialmente o benefício terapêutico da estimulação. Os eletrodos direcionais de DBS podem aumentar a janela terapêutica de estimulação, fornecendo um meio de evitar a propagação da corrente para estruturas que podem dar origem a efeitos colaterais relacionados à estimulação. Da mesma forma, o controle da corrente para contatos individuais em um eletrodo DBS permite a formação do campo elétrico produzido entre vários contatos ativos. A revisão a seguir tem como objetivo descrever os desenvolvimentos recentes na tecnologia do sistema DBS e os recursos de cada sistema DBS disponível comercialmente. As vantagens de cada sistema são revisadas e considerações gerais para a escolha do sistema mais apropriado são discutidas.
O desenvolvimento da estimulação cerebral profunda (DBS) há mais de 30 anos forneceu um meio de aliviar as condições de pacientes com uma variedade de distúrbios do movimento e desde então se tornou cada vez mais importante no tratamento da doença de Parkinson (DP) [1,2]. Os dois alvos mais comuns para DBS para DP são o globus pallidus internus (GPi) e o núcleo subtalâmico (STN). Embora ambos os alvos sejam eficazes para reduzir as discinesias induzidas pela levodopa e melhorar a mobilidade, o STN-DBS tem o benefício adicional de reduzir a necessidade diária de levodopa; por outro lado, o GPi é considerado um alvo mais seguro do ponto de vista psiquiátrico e cognitivo [3-5].
A cirurgia DBS tem se mostrado eficaz para melhorar os sintomas motores e a qualidade de vida de pacientes com DP; no entanto, existem alguns sintomas que podem ser resistentes ou refratários à estimulação. Por exemplo, marcha, fala e disfunção postural tendem a deteriorar-se independentemente e em um ritmo mais rápido do que os sintomas apendiculares [6]. O STN-DBS em particular é conhecido por exacerbar a gagueira e a hipofonia em pacientes com DP [7]. Além disso, a estimulação em contatos que residem em regiões específicas do STN pode ter efeitos diferenciais sobre os sintomas axiais e apendiculares. Por exemplo, a estimulação da metade dorsal do STN lateral mostrou melhorar a velocidade do passo, comprimento e equilíbrio em comparação com a estimulação das regiões ventrais [8]. O potencial do STN-DBS para afetar adversamente os sintomas axiais é exemplificado por um relato de caso em que o congelamento de novo da marcha (FOG - freezing of gait) foi produzido com estimulação da região anteromedial do STN [9]. Por outro lado, GPi DBS está associado a menos eventos adversos axiais, embora esta observação venha principalmente de estudos abertos não controlados [6]. Essas descobertas demonstram possíveis desafios que podem surgir ao otimizar as configurações de estimulação para pacientes individuais.
O potencial terapêutico do DBS depende fortemente do posicionamento ideal do eletrodo DBS dentro do núcleo alvo. Embora várias técnicas de localização, como orientação de imagem, gravações de microeletrodos e avaliação clínica, possam ser implementadas durante o procedimento cirúrgico, pequenos desvios da trajetória planejada podem resultar em uma janela terapêutica reduzida para estimulação. O STN é um pequeno núcleo em forma de lente medindo aproximadamente 8 mm de comprimento e 6 mm de largura que é dividido em regiões sensório-motoras dorsolaterais, associativas e límbicas medioventrais [10]. Estudos demonstraram que a implantação ideal do eletrodo na região dorsolateral do STN é necessária para produzir melhorias nos sintomas motores, evitando efeitos colaterais relacionados à estimulação [11,12]. As revisões do eletrodo DBS são incomuns devido ao risco de complicações cirúrgicas; assim, os médicos podem ter que confiar em estratégias de programação para otimizar o benefício terapêutico no caso de eletrodos DBS colocados de forma subótima.
A obtenção de uma resposta clínica ideal enquanto minimiza os efeitos colaterais relacionados à estimulação pode ser alcançada na maioria dos casos, manipulando os parâmetros de estimulação, como polaridade do eletrodo, frequência, largura de pulso e voltagem, bem como modelando o volume de ativação do tecido (VTA - volume of tissue activation) . Por exemplo, a estimulação bipolar pode estreitar a forma do VTA para evitar as fibras da cápsula interna ou outras estruturas eloquentes. Além disso, alguns estudos relataram melhorias na marcha com a mudança para estimulação de alta voltagem de baixa frequência (60 Hz) [13,14], em oposição aos protocolos padrão que implementam a estimulação de alta frequência (HFS). Recentemente, os avanços tecnológicos em sistemas DBS deram origem a estratégias de programação adicionais que permitem maior flexibilidade na manipulação de parâmetros de estimulação. Esses avanços podem ajudar os médicos a otimizar as configurações do programa para pacientes com sintomas parkinsonianos complexos ou eletrodos DBS posicionados de forma subótima. A presente revisão irá discutir novas técnicas de estimulação implementadas pela última geração de sistemas DBS com foco nas características exclusivas de cada sistema.
ATUALIZAÇÃO NA ESTIMULAÇÃO
Os objetivos da programação efetiva do DBS em ordem de importância são maximizar o benefício clínico, evitar os efeitos colaterais relacionados à estimulação e minimizar o consumo atual [15]. Em geral, a estimulação por meio de um eletrodo DBS posicionado de forma ideal deve produzir um benefício clínico significativo com consumo de energia relativamente baixo. A estimulação monopolar, na qual um (ou dois no caso de ‘duplo monopolar’) dos contatos do eletrodo serve como um cátodo contra o gerador de pulso implantável (IPG), produz uma difusão radial de corrente em torno do contato ativo. O raio do VTA aumenta com o aumento da amplitude (tensão ou corrente). Por outro lado, na estimulação bipolar, um contato serve como o cátodo, enquanto outro serve como o ânodo. Isso produz um VTA mais estreito com a maior força de campo centrada em torno do cátodo. A estimulação bipolar pode ser útil nos casos em que o VTA produzido pela estimulação monopolar viola as estruturas eloquentes circundantes, levando a efeitos colaterais. Curiosamente, a estimulação bipolar está associada a uma vida útil mais longa da bateria do que a estimulação monopolar dupla e até mesmo monopolar usando um IPG de tensão constante [16]. O benefício terapêutico do STN-DBS em pacientes com DP foi observado com frequências de estimulação maiores que 50 Hz, e melhorias clínicas na rigidez e bradicinesia são maximizadas em aproximadamente 130 Hz [17]. Por outro lado, a estimulação em 5 Hz foi observada para piorar os sintomas de rigidez e bradicinesia [17].
Corrente constante
Até recentemente, todos os DBS IPGs utilizavam estimulação controlada por tensão constante de fonte única. A consequência deste projeto é que a impedância do eletrodo DBS na interface de contato-tecido determina a magnitude do fluxo de corrente para os elementos neurais e esta impedância pode mudar ao longo do tempo (por exemplo, após substituições de IPG). Os IPGs atuais da Medtronic podem fornecer estimulação com constante de tensão ou com constante de corrente, mas a primeira é geralmente preferida, pois há mais opções de programação disponíveis. Atualmente, a maioria dos fabricantes produz apenas IPGs com constante de corrente.
Largura do pulso
A largura de pulso geralmente é mantida na duração mais baixa de 60 μs, a menos que haja falta de benefício clínico com o aumento da amplitude [15]. Enquanto a quantidade de corrente necessária para excitar o tecido neural diminui com o aumento da largura de pulso [18], a amplitude pode ser mais facilmente manipulada com a maioria dos IPGs [15]. O encurtamento da largura de pulso para <60 μs mostrou alguma utilidade no aumento da janela terapêutica de estimulação, ou seja, a faixa de amplitudes que produzem benefício clínico sem efeitos colaterais [19]. Larguras de pulso <60 μs só são possíveis com o uso de IPGs mais novos, alguns dos quais são compatíveis com eletrodos produzidos por diferentes fabricantes [20]. O encurtamento da largura de pulso abaixo de 60 μs demonstrou reduzir os efeitos colaterais relacionados à estimulação e aumentar a janela terapêutica de estimulação em dois pacientes com tremor essencial (TE) quando eles foram trocados de um Medtronic IPG para um Boston Scientific Vercise IPG [20].
Frequência
A frequência de estimulação variável foi recentemente explorada para tratar os sintomas da marcha e axiais em DP que responderam mal ao HFS tradicional de 130 Hz. DBS visando o núcleo pedunclopontino é um procedimento experimental previamente investigado para tratar FOG em pacientes com DP, e suas configurações de estimulação ideais utilizaram frequências mais baixas do que outros alvos, mais comumente frequências <60 Hz [21]. A estimulação de baixa frequência (LFS) foi hipotetizada para fornecer melhor controle dos sintomas axiais, incluindo FOG, mesmo quando entregue ao STN [13]. Em um pequeno estudo de 13 pacientes com DP com FOG e sintomas axiais proeminentes, o LFS melhorou a marcha e reduziu os episódios de congelamento, mantendo uma redução no escore motor da Escala de Avaliação Unificada de DP (UPDRS), embora a maioria dos pacientes tivesse que aumentar sua levodopa dose para mitigar o agravamento dos sintomas parkinsonianos [13]. Da mesma forma, o LFS foi encontrado para melhorar a marcha e os sintomas axiais em uma coorte de 14 pacientes, e os contatos ideais para LFS foram localizados ventralmente aos contatos para HFS ideal de 130 Hz [22]. A estimulação de frequência variável (VFS) envolve alternar HFS com LFS. Jia et al. [23] propuseram que a VFS pode servir como uma estratégia eficaz para o tratamento de FOG e sintomas axiais em pacientes com DP, mantendo o tratamento ideal dos sintomas apendiculares. Isso foi exemplificado em um caso de um paciente com DP com FOG que melhorou com VFS. Posteriormente, um pequeno estudo de caso de 4 pacientes com DP com sintomas de FOG demonstrou que o VFS melhorou a velocidade da marcha e reduziu os episódios de FOG [24]. Além disso, um estudo aberto agudo descobriu que a frequência de estimulação alta de 10 kHz foi relatada para produzir boa mobilidade com menos parestesias induzidas por estimulação e distúrbios da fala do que a frequência de estimulação tradicional de 130 Hz [25].
Fracionamento temporal
O fracionamento temporal envolve o uso de dois programas separados de forma alternada por meio de um único eletrodo DBS. Os dois programas podem ter diferentes amplitudes, polaridades e larguras de pulso; no entanto, a frequência deve ser a mesma, com uma frequência máxima permitida de 125 Hz (ou seja, a saída máxima do IPG é 250 Hz). Este método de estimulação permite que diferentes áreas do núcleo alvo sejam estimuladas simultaneamente. Esta tecnologia é geralmente conhecida como ‘estimulação de intercalação’ (interleaving stimulation), introduzida pela Medtronic; uma tecnologia semelhante é chamada de 'conjunto multi-stim' em dispositivos Abbott (veja abaixo).
Relatos de casos descreveram que a estimulação intercalada é eficaz no tratamento da distonia refratária [26] e no tratamento dos sintomas predominantes de tremor em um paciente com DP e TE (essential tremor) comórbidos [27]. Esta tecnologia pode ser particularmente útil nos casos em que um eletrodo DBS é colocado de forma subótima. Miocinovic et al. [28] descreveram 3 pacientes, cada um dos quais tinha um eletrodo DBS posicionado de forma subótima dentro do STN. A estimulação usando vários programas monopolar e duplo monopolar melhorou alguns sintomas, mas piorou outros e causou efeitos colaterais relacionados à estimulação. O uso de programas de intercalação foi eficaz para fornecer estimulação das áreas desejadas, evitando estruturas circundantes. Da mesma forma, Zhang et al. [29] relataram uma série de 12 pacientes nos quais vários ensaios de estimulação convencional foram ineficazes no controle de vários sintomas. Antes de implementar a estimulação interleaving ou intercalada, as queixas dos pacientes incluíam disartria, discinesias relacionadas à estimulação, distúrbios da marcha e controle incompleto dos sintomas parkinsonianos. A avaliação de ressonância magnética revelou uma colocação subótima do eletrodo afetado na maioria dos pacientes desta série; entretanto, o controle adequado dos sintomas pode ser alcançado em todos com a estimulação intercalada. Além de evitar os efeitos colaterais relacionados à estimulação, a estimulação intercalada demonstrou melhorar as discinesias em um subconjunto de pacientes com DP. Curiosamente, este efeito foi alcançado com a ativação de um contato dorsal residindo na zona incerta, logo fora do STN [30]. Esses relatórios exemplificam como a intercalação fornece maior flexibilidade na programação, permitindo ao médico equilibrar melhor os sintomas parkinsonianos e os efeitos colaterais relacionados à estimulação.
Fracionamento atual
O conceito de fracionamento de corrente envolve várias fontes de corrente independentes que aplicam corrente constante através de cada eletrodo, permitindo ao médico controlar diretamente a quantidade de corrente fornecida aos tecidos circundantes. O controle do fluxo de corrente através de cada contato individualmente é denominado controle de corrente independente múltiplo (MICC - multiple independent current control) no Boston Scientific IPGs. Utilizando este paradigma, a corrente pode ser distribuída de forma controlada entre vários contatos, permitindo que o VTA seja ajustado para um formato desejado para se ajustar à região alvo [31]. O fracionamento atual é diferente do fracionamento temporal, que usa tecnologias como intercalação (veja acima).
MICC não é possível em dispositivos Abbott, que usam um método diferente - menos versátil - chamado de coativação.
Coativação
A coativação permite que múltiplos contatos sejam estimulados como se fossem um único eletrodo (veja abaixo). Em um estudo de modelagem, a coativação mostrou estar associada a um menor consumo de energia do que o MICC devido à impedância reduzida na interface eletrodo-tecido [32].
Modelos computacionais demonstraram que a direção de corrente contínua pode ter o potencial de estimular as populações neuronais desejadas, mesmo no caso de eletrodos DBS colocados de forma subótima [31,33]. Na verdade, com base nesses modelos, a estimulação terapêutica seletiva pode ser alcançada em uma variedade de localizações de eletrodos [33]. A utilidade deste método de estimulação foi demonstrada em algumas séries de casos e relatos de casos. Por exemplo, a direção atual para deslocar a estimulação em direção a um contato mais proximal, mudando a forma do VTA para uma distribuição em forma de lágrima foi usada em um paciente que desenvolveu discinesias com amplitude crescente em seu contato terapêutico mais usado. Isso efetivamente aliviou os sintomas parkinsonianos do paciente, sem provocar discinesias [34].
No entanto, alvejar com tal precisão exigiria informações detalhadas sobre a localização do eletrodo dentro do núcleo alvo do indivíduo e, consequentemente, pode complicar o processo de programação. Os autores sugerem que o software de visualização pode ajudar a guiar os médicos por meio de modelos computacionais específicos do paciente durante o processo de programação [33]. Por exemplo, o sistema GUIDE da Boston Scientific (Valencia, CA, EUA) é um software visual tridimensional que fornece informações sobre a localização do eletrodo DBS com base em imagens de ressonância magnética pré-operatória e tomografia computadorizada pós-operatória. O VTA pode ser modelado quando as configurações de estimulação são selecionadas, permitindo que os médicos visualizem o VTA resultante em relação às estruturas circundantes. O uso deste software de programação reduziu a duração da sessão de programação inicial em 75% [35].
Estimulação anódica
Tradicionalmente, a estimulação catódica tem sido favorecida, uma vez que a ativação das fibras mielinizadas requer de 3 a 8 vezes mais força de estimulação quando o contato ativo atua como um ânodo [36]. Por esta razão, os sistemas DBS de primeira geração foram projetados de forma que o caso IPG servisse como ânodo, enquanto o contato ativo servisse como cátodo. Teoricamente, o contato ativo em um eletrodo DBS pode atuar como um cátodo ou um ânodo. Acredita-se que a estimulação catódica e anódica afetam diferencialmente o tecido neural dependendo da orientação das fibras, de modo que as fibras que passam são ativadas por estimulação catódica e as fibras ortogonalmente orientadas são ativadas por estimulação anódica [37]. Com o recente desenvolvimento de sistemas DBS de segunda geração que permitem maior flexibilidade nos parâmetros de estimulação, os efeitos da estimulação anódica em comparação com a estimulação catódica foram estudados [38,39]. Kirsch et al. [38] estudaram a estimulação anódica em 10 pacientes com DP e relataram limiares de efeitos colaterais mais altos e escores motores UPDRS III mais baixos com estimulação anódica do que com estimulação catódica. Outro estudo envolvendo 10 pacientes com DP encontrou uma janela terapêutica aumentada e um limiar mais alto de efeitos colaterais com estimulação anódica [39]. No entanto, a estimulação anódica não foi capaz de controlar os tremores em dois pacientes, e a estimulação anódica também é conhecida por resultar em maior consumo de bateria [39].
Estimulação semibipolar
Na estimulação semibipolar, o ânodo é dividido igualmente entre o caso IPG e outro contato no eletrodo DBS. Com base na experiência clínica, acredita-se que essa configuração seja útil para evitar efeitos colaterais relacionados à estimulação. Soh et al. [39] compararam os efeitos da estimulação semibipolar com a estimulação bipolar, catódica monopolar e anódica monopolar em um grupo de estudo de 10 pacientes com DP. A estimulação semibipolar apresentou um limiar de efeito colateral significativamente maior do que a estimulação catódica; além disso, a estimulação semibipolar apresentou menor consumo de bateria do que a estimulação bipolar [39].
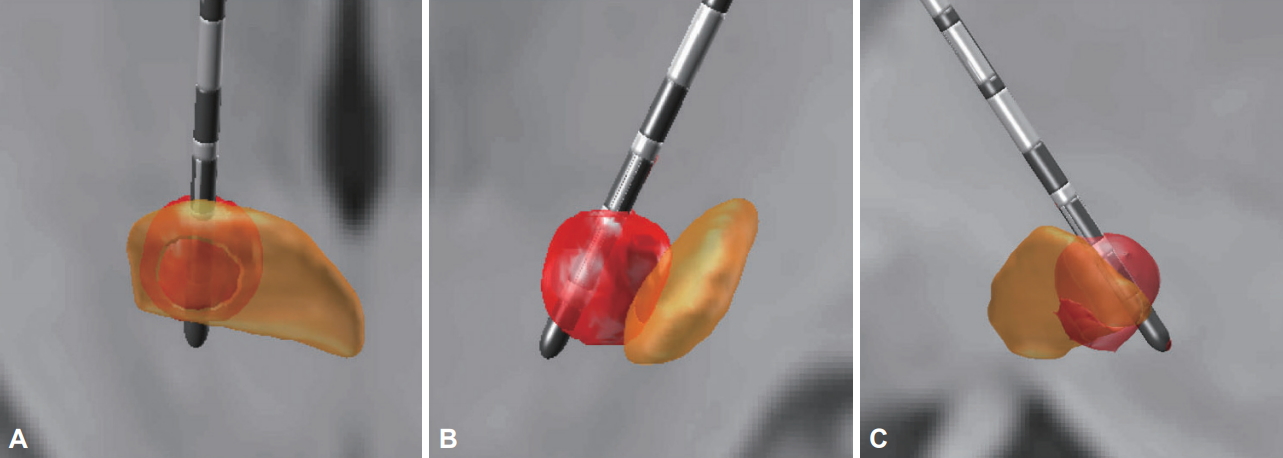
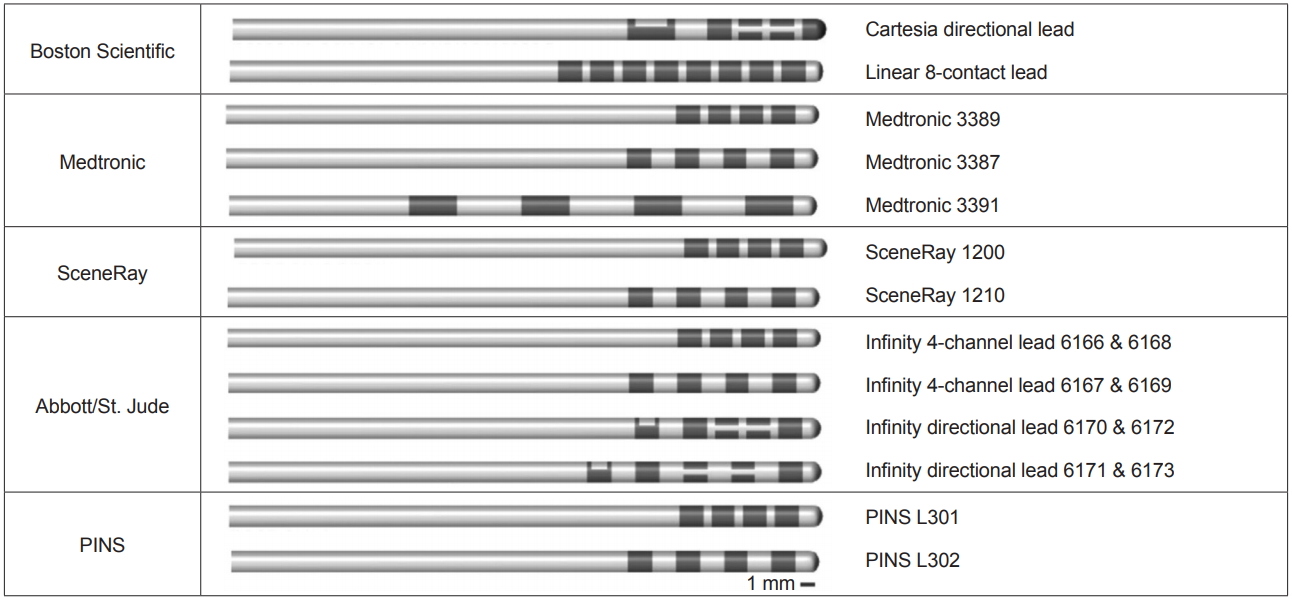
Eletrodos direcionais
O projeto do eletrodo do DBS apresentou um crescimento significativo nos últimos anos com o desenvolvimento de eletrodos direcionais disponíveis comercialmente. A estrutura do condutor DBS tradicional consiste em 4 contatos de 1,5 mm de comprimento separados um do outro por espaços de 1,5 mm no caso do modelo Medtronic 3387 e de 0,5 mm no caso do modelo Medtronic 3389. Conforme descrito anteriormente, a estimulação monopolar produz um campo elétrico esférico que se difunde radialmente a partir do contato ativo. Os condutores direcionais, por outro lado, contêm vários contatos em uma distribuição radial ao redor do eixo do condutor DBS. Cada contato pode ser estimulado individualmente ou em combinação por meio de fracionamento temporal (dispositivos Abbott) ou fracionamento de corrente (MICC, Boston Scientific). A passagem de corrente através de contatos individuais permite a corrente
A passagem da corrente pelos contatos individuais permite o direcionamento da corrente ao longo de um vetor perpendicular ao condutor. Os condutores direcionais disponíveis comercialmente têm uma configuração de anel circunferencial composta de 3 contatos individuais. A estimulação através de todos os 3 contatos simultaneamente produz um campo elétrico equivalente ao da estimulação monopolar por meio de um eletrodo DBS tradicional. É importante ressaltar que o menor tamanho de cada contato individual leva a uma maior densidade de campo elétrico na interface contato-tecido; portanto, menos corrente é necessária para produzir um efeito terapêutico. Este recurso pode contribuir potencialmente para preservar a vida útil da bateria.
A vantagem do projeto do eletrodo direcional foi proposta pela primeira vez por modelos computacionais [40,41]. Um desses modelos sugeriu que a direção da corrente através de eletrodos segmentados poderia deslocar o centro do VTA em até 1,0-1,3 mm [42]. Embora essa distância possa parecer insuficiente para compensar um eletrodo DBS mal posicionado, estudos em seres humanos demonstraram que a estimulação direcional por meio de um contato mais favorável pode aumentar a janela terapêutica para estimulação e aumentar o limite atual para a produção de efeitos colaterais [43-45].
Dois estudos iniciais realizados em pacientes com DP foram apenas intraoperatórios [44,46]. Pollo et al. [44] calcularam que a janela terapêutica média foi 41,3% maior do que a estimulação omnidirecional, e a corrente terapêutica média foi 43% menor para a melhor estimulação direcional do que para a estimulação omnidirecional. Contarino et al. [46] encontraram resultados semelhantes em um estudo intraoperatório duplo-cego em oito pacientes com DP por meio de um eletrodo de 32 contatos não comercializado. Dembek et al. [43] investigaram o benefício clínico da estimulação direcional em um estudo duplo-cego cruzado crônico no qual os pacientes receberam um ensaio de melhor estimulação direcional em comparação com a omnidirecional. Este grupo não encontrou nenhuma diferença nos resultados motores entre as duas condições, exceto uma diferença positiva significativa na rotação da mão na condição direcional.
A utilidade dos eletrodos direcionais para STN-DBS foi demonstrada no estudo PROGRESS, no qual 234 pacientes com DP foram implantados com eletrodos direcionais Abbott direcionados ao STN [47]. Durante os primeiros três meses, os pacientes receberam estimulação omnidirecional tradicional e, durante o período de 3 meses seguinte, os pacientes foram trocados para a estimulação direcional. Os resultados deste estudo prospectivo cruzado de braço único produziram um aumento médio significativo de 41% na janela terapêutica para estimulação com estimulação direcional. Além disso, a quantidade de corrente necessária para produzir efeitos terapêuticos foi reduzida em 39% [47]. A capacidade e limitação dos condutores direcionais para a corrente de direção, no caso de um condutor DBS mal colocado, está representada na Figura 1.
Figura 1.A: Estimulação do STN dorsolateral por meio de um eletrodo DBS posicionado de maneira ideal. B: O direcionamento da corrente através de uma derivação DBS direcional não é capaz de compensar uma derivação mal colocada que reside fora do núcleo alvo. C: O uso de direcionamento de corrente por meio de um eletrodo direcional posicionado ligeiramente posterior ao STN é capaz de direcionar a corrente para o STN dorsolateral. STN: núcleo subtalâmico, DBS: estimulação cerebral profunda.
Uma desvantagem potencial dos eletrodos direcionais é o aumento da complexidade da programação devido à adição de vários contatos direcionados em diferentes orientações. Felizmente, a revisão monopolar pode ser realizada de maneira semelhante aos tipos de eletrodos tradicionais, e a estimulação direcional pode ser implementada apenas se necessária para tratar os efeitos colaterais ou sintomas complexos. Algoritmos que implementam modelos anatômicos baseados em imagens de ressonância magnética e tensor de difusão para automatizar a programação do eletrodo direcional foram propostos [48]. No entanto, é provável que o acesso a essa tecnologia seja um fator limitante para muitos neurologistas comunitários.
Fabricantes de sistema DBS (segue um compilado dos geradores de pulso implantáveis de diferentes fabricantes com seus potenciais de programação e sua características técnicas)
Medtronic, Dublin, Ireland;
Abbott, (St. Paul, MN, USA);
Boston Scientific;
PINS Medical Co., Ltd. (Beijing, China);
SceneRay Co., Ltd. (Suzhou, China).
Tabela 1: Características dos geradores de pulso implantáveis disponíveis atualmente
(ver na fonte Table 1)
Figura 2.Representação visual em escala dos eletrodos de estimulação cerebral profunda atualmente disponíveis no mercado. As características e medidas de cada tipo de eletrodo estão resumidas na Tabela 2. (na fonte)
ESCOLHENDO O MELHOR SISTEMA
Muitos fatores podem contribuir para a escolha do sistema, incluindo o alvo anatômico, fatores do paciente e preferências do cirurgião e do neurologista. A escolha de usar eletrodos quadripolares tradicionais versus eletrodos direcionais é mais aplicável quando se considera o tamanho do núcleo alvo e o potencial para efeitos colaterais relacionados à estimulação. Por outro lado, os fatores do paciente são importantes ao considerar o uso de um IPG recarregável e não recarregável. Embora dispositivos recarregáveis sejam propostos para reduzir o número de trocas de bateria, poupando o paciente de procedimentos cirúrgicos repetidos, os pacientes devem ser confiáveis e capazes de recarregar a bateria de forma consistente. Embora o Medtronic Activa RC e o Boston Scientific Gevia exijam a cobrança apenas uma vez por semana, os pacientes com deficiência ou sem apoio social podem ter dificuldade em assumir essa responsabilidade. Além disso, a escolha do sistema DBS depende muito das preferências e do conforto dos cirurgiões e neurologistas responsáveis pelo tratamento. Muitos médicos têm vasta experiência no uso do sistema Medtronic, pois a Medtronic dominou o mercado nas últimas décadas. Pacientes que vivem em regiões remotas ou que têm probabilidade de se mudar podem descobrir que os dispositivos da Medtronic estão mais amplamente disponíveis.
Considerações anatômicas
O STN é um núcleo pequeno, medindo apenas 6-8 mm em sua maior dimensão. Uma trajetória típica de um eletrodo DBS através do STN começa na borda dorsolateral e se projeta medial e ventralmente, evitando idealmente as regiões associativa e límbica. Envolvendo o núcleo lateralmente e, até certo ponto, anteriormente, está a cápsula interna. Um eletrodo posicionado muito lateralmente dentro do STN pode produzir contrações contralaterais na face e nos membros por meio da propagação da corrente para as fibras da cápsula interna. Um eletrodo posicionado muito medial pode estimular as fibras do trato oculomotor adjacente, resultando em desvio ocular e diplopia. Além disso, houve relatos de estimulação de contatos localizados ventralmente causando episódios hipomaníacos agudos [64], bem como estimulação da substância negra subjacente, resultando em hipomania e depressão [65,66]. Eletrodos posicionados anteriormente podem se projetar na região hipotalâmica lateral, levando a efeitos autonômicos relacionados à estimulação, como sudorese e náusea.
O GPi, ao contrário do STN, é um alvo maior associado a uma menor incidência de efeitos colaterais. A cápsula interna faz fronteira com o GPi anteriormente e medialmente, e o trato óptico está localizado ventralmente. Também localizado ventralmente ao GPi está a ansa lenticularis, que separa o GPi do núcleo basal de Meynert e da amígdala. Uma trajetória típica do eletrodo DBS se estende ao longo do aspecto póstero-lateral do GPi e apenas dorsal ao trato óptico. Embora os efeitos colaterais sejam geralmente raros, a colocação medial ou posterior do eletrodo DBS pode resultar em estimulação capsular e contrações contralaterais da face e dos membros, e o desvio ventral pode produzir fosfeno e fenômenos visuais.
O potencial para efeitos colaterais relacionados à estimulação com STN-DBS pode justificar a consideração de eletrodos DBS direcionais. Um ponto técnico a ser considerado ao implantar eletrodos direcionais é que o segundo e terceiro níveis de contatos contêm os contatos direcionais, de modo que o eletrodo pode precisar ser implantado mais profundamente do que o normal para colocar os contatos direcionais na região alvo.
Outra estratégia potencial para aumentar a janela terapêutica para estimulação, evitando efeitos colaterais induzidos por estimulação, é o uso de larguras de pulso menores <60 μs. Estudos experimentais em animais demonstraram que os axônios são mais excitáveis do que os corpos celulares [18], e o limiar para ativação de elementos neurais varia com a força do estímulo e a largura do pulso. Larguras de pulso mais longas podem facilitar a estimulação de diâmetros maiores, axônios mielinizados, como aqueles que surgem dos tratos piramidais, e larguras de pulso mais curtas são consideradas direcionadas à corrente para corpos celulares e axônios menores. Reich et al. [19] observaram uma relação inversa entre a duração da largura de pulso e o limite para efeitos colaterais em um grupo de estudo de quatro pacientes com STN-DBS. Os autores implementaram o sistema de neuroestimulação Boston Scientific Vercise para entrega de larguras de pulso <60 μs e observaram um aumento de duas vezes na janela terapêutica de estimulação com uma largura de pulso de 30 μs em comparação com a largura de pulso padrão de 60 μs. Atualmente, os sistemas Boston Scientific Vercise e Abbott Infinity permitem larguras de pulso menores que 60 μs.
IPGs recarregáveis vs. não recarregáveis
O IPG não recarregável mais comum, o Medtronic Activa PC, tem uma vida útil média da bateria variando de 2,6 a 4,5 anos [60,61,67,68], que é aproximadamente 2,5 anos mais curta do que seu antecessor, o Kinetra [61]. Isso é consideravelmente mais curto do que a vida útil comercializada do PC, que é anunciada em aproximadamente 5 anos.
A vida útil de um IPG é amplamente dependente das demandas atuais das configurações de estimulação do paciente, com a estimulação de alta voltagem exigindo trocas de bateria mais frequentes. IPGs recarregáveis foram introduzidos pela primeira vez em 2008, e a vida útil prevista de IPGs recarregáveis de acordo com os fabricantes varia de 10 para Brio (Abbott / St. Jude) a 15 (Medtronic), até 25 (Boston Scientific) anos, que ainda não foi confirmado.
O objetivo dos IPGs recarregáveis é reduzir o número de trocas de bateria, o que pode reduzir os custos associados a vários procedimentos cirúrgicos e minimizar as chances de infecções de hardware. Alguns estudos relataram um aumento na incidência de infecções com substituições repetidas de IPG [69,70], mas um estudo não encontrou tal associação [71]. No entanto, o uso de um IPG recarregável durante um período de 9 anos (a vida útil inicialmente aprovada do Activa RC) foi estimado para levar a uma economia de $ 60.900 com base em um estudo de centro único envolvendo 206 pacientes [72]. Desde que IPGs recarregáveis se tornaram disponíveis, muitos pacientes mudaram para dispositivos recarregáveis e alguns até receberam IPGs recarregáveis durante o implante inicial de DBS [72,73]. Pesquisas com pacientes demonstraram que a grande maioria dos pacientes considera o processo de recarga fácil e a incidência de eventos adversos e interrupções temporárias na terapia é baixa [67,72,73].
A decisão de usar um IPG recarregável em vez de um não recarregável é geralmente deixada ao critério do médico assistente e pode ser influenciada pelos requisitos atuais das configurações de estimulação, bem como pela confiabilidade do paciente para recarregar seu dispositivo (Tabela 3). O Multi-Recharge Trial, conduzido em quatro centros neurocirúrgicos em toda a Alemanha, relatou os resultados da pesquisa de 56 pacientes trocados para IPGs recarregáveis e 139 pacientes que receberam IPGs recarregáveis durante a implantação de DBS [67]. De acordo com os resultados da pesquisa, os pacientes carregaram seus IPGs uma vez a cada 10 ± 8 dias e gastaram uma média de 122 ± 175 minutos por semana recarregando seus dispositivos. Pacientes com distonia descobriram que o processo de recarga é significativamente mais conveniente do que pacientes com DP.
Curiosamente, descobriu-se que o Activa RC requer muito mais tempo de carregamento por semana do que o Boston Scientific Vercise e o Abbott (St. Jude) Brio. Embora falhas de carregamento fossem incomuns, eram mais prováveis de ocorrer com pacientes que mudaram de um IPG não recarregável. Embora a decisão de usar um IPG recarregável deva levar em consideração os fatores do paciente, os resultados desses estudos sugerem que os IPGs recarregáveis são eficazes e fáceis de gerenciar, mesmo em pacientes mais velhos [67,73].
CONCLUSÕES
Os avanços tecnológicos em hardware e software DBS atualmente compreendem a maior área de crescimento dentro do campo da neurocirurgia funcional. Embora os estudos que avaliam os recursos dos novos sistemas DBS tenham encontrado ganhos nas medidas de estimulação eficaz, mais pesquisas são necessárias para caracterizar o impacto dessas tecnologias nos resultados dos pacientes e na qualidade de vida. Em um estudo transversal, com base em questionário e de pequena amostra, verificou-se que os pacientes tratados com um sistema DBS estabelecido (Medtronic) estavam menos inclinados a pensar que a programação adicional levaria a melhorias adicionais, sugerindo assim que os recursos adicionais do dispositivos mais novos podem complicar a programação DBS dos pacientes, aumentando o número de visitas necessárias para convencer os pacientes de que a estimulação é otimizada e, portanto, possivelmente aumentando as frustrações de médicos e pacientes [74].
Muitos dos recursos desses novos sistemas concentram-se atualmente em minimizar os efeitos colaterais relacionados à estimulação. É necessária uma compreensão mais aprofundada da fisiopatologia desses distúrbios - e da DP em particular - para determinar se a terapia com DBS é capaz de abordar os sintomas refratários aos medicamentos padrão ou DBS, como instabilidade postural, ataxia e FOG. A exploração de outros alvos cirúrgicos, como o substancial nigra pars reticulata [75,76] e o núcleo pedunculopontino [77,78], buscou abordar o FOG resistente à levodopa na DP. Com a pesquisa contínua, percepções mais profundas sobre as redes neurais que contribuem para esses distúrbios em sinergia com os avanços na tecnologia de estimulação, esperançosamente, produzirão novas terapias que podem melhorar a qualidade de vida desses pacientes.
Seguem Notas, agradecimentos e referências bibliográficas. Original em inglês, tradução Google, revisão Hugo. Fonte: Journal of Movement Disorders.