January 19, 2024 - Quando CASGEVY, a primeira terapia baseada em CRISPR, foi aprovada pela FDA em dezembro, deu à tecnologia CRISPR a validação necessária. Qualquer promessa que tivesse realizado antes daquele momento era simplesmente investigativa. Neste caso, foi concedida a aprovação do CASGEVY para o tratamento de duas doenças sanguíneas – doença falciforme (DF) e beta-talassemia. Mas e se o CRISPR também pudesse tornar-se uma ferramenta vital no tratamento de doenças neurodegenerativas?
As doenças neurodegenerativas são tremendamente difíceis de tratar. Como apontou Cem Zorlular, diretor executivo (CEO) da Er-Kim Pharmaceuticals, o cérebro tem “bilhões de neurônios e trilhões de conexões”. Em última análise, tem uma estrutura extremamente complexa que os cientistas ainda não compreenderam completamente.
Zorlular continuou: “Essa complexidade torna difícil atingir regiões específicas do cérebro com tratamentos. Além disso, as doenças neurodegenerativas têm frequentemente um longo período latente, o que significa que os sintomas podem não se manifestar durante muitos anos após o início da doença. “Esta situação complica o desenvolvimento de tratamentos que possam retardar ou prevenir a progressão da doença.”
Apesar disso, uma técnica de edição genética como o CRISPR pode ser uma abordagem promissora. “É particularmente relevante para doenças neurodegenerativas como Alzheimer e Parkinson, caracterizadas pela perda contínua de neurônios e redes nervosas, levando a distúrbios de movimento, problemas cognitivos e dificuldades de fala e respiração”, explicou Zorlular. “O Alzheimer, por exemplo, está ligado a mutações em genes específicos como APP, PSEN1 e PSEN2. “O CRISPR pode editar estes genes, potencialmente abordando as causas subjacentes destas doenças.”
Neste momento, a investigação sobre a utilização do CRISPR para doenças neurodegenerativas ainda está numa fase inicial. Neste artigo, exploramos vários estudos que avaliam como o CRISPR poderia ser usado para tratar as duas doenças neurodegenerativas mais comuns, a doença de Alzheimer e a doença de Parkinson, bem como a doença hereditária rara conhecida como doença de Huntington.
Duas abordagens baseadas em CRISPR para a doença de Alzheimer reveladas na Conferência Internacional da Associação de Alzheimer
Na Conferência Internacional da Associação de Alzheimer (AAIC) em Amsterdã no ano passado, os pesquisadores revelaram dois métodos de utilização do CRISPR para a doença de Alzheimer, ambos analisando maneiras pelas quais os genes podem aumentar o risco de desenvolver a doença de Alzheimer e como a edição desses genes poderia reduzir o risco de desenvolver a doença ou proteger o cérebro do acúmulo de amiloide, que se acredita ser a causa única da doença.
O primeiro estudo veio de pesquisadores da Universidade de San Diego. Eles desenvolveram uma estratégia de edição genética usando CRISPR que tem como alvo a proteína precursora de amiloide (APP) – uma proteína responsável pela superprodução de beta-amilóide no cérebro, o que eventualmente leva ao acúmulo de placas que são uma marca registrada do Alzheimer. O gene APP produz diversos produtos, alguns dos quais são protetores, enquanto outros estão associados a patologias, como o beta-amilóide. Na sua abordagem, os cientistas pretendiam diminuir a produção de beta-amilóide e, ao mesmo tempo, aumentar as ações neuroprotetoras.
Os pesquisadores realizaram experimentos em ratos com doença de Alzheimer para testar sua estratégia. Aqui, eles descobriram que o tratamento CRISPR resultou numa redução nas placas beta-amilóides e numa diminuição nos marcadores de inflamação cerebral. Eles também observaram um aumento nos produtos de APP neuroprotetores, bem como melhorias na função comportamental e do sistema nervoso. Além disso, a edição genética não causou efeitos colaterais indesejáveis em ratos saudáveis.
Enquanto isso, no segundo estudo, os pesquisadores da Duke University desenvolveram outra abordagem CRISPR, desta vez visando um fator de risco genético para a doença neurodegenerativa chamada APOE-e4. Herdar este gene aumenta a probabilidade de alguém desenvolver a doença de Alzheimer. Embora a presença do gene não seja uma garantia de que uma pessoa contrairá a doença, as pessoas que têm uma cópia têm um risco duas a três vezes maior de contraí-la, enquanto duas cópias aumentam o risco de oito a doze vezes.
Neste estudo, os pesquisadores usaram uma plataforma de terapia de epigenoma baseada na estratégia de edição CRISPR/dCas9 para reduzir os níveis de APOE-e4. Descobriu-se que o principal candidato desta plataforma reduz os níveis de APOE-e4 em cérebros em miniatura derivados de células-tronco pluripotentes induzidas por humanos de um paciente com Alzheimer, bem como em modelos de camundongos humanizados. Além disso, a abordagem não afetou os níveis de outras variantes da APOE que se acredita terem um efeito neutro ou protetor.
É claro que esses estudos ainda estão em seus estágios iniciais. Mas com os tratamentos recentemente aprovados para a doença de Alzheimer que causam efeitos secundários potencialmente graves, é necessário encontrar abordagens mais inovadoras para tratar a doença neurodegenerativa, como as apresentadas nestes artigos CRISPR.
É claro que esses estudos ainda estão em seus estágios iniciais. Mas com os tratamentos recentemente aprovados para a doença de Alzheimer que causam efeitos secundários potencialmente graves, é vital encontrar abordagens mais inovadoras para tratar a doença neurodegenerativa, como as destes estudos CRISPR.
CRISPR para doença de Parkinson
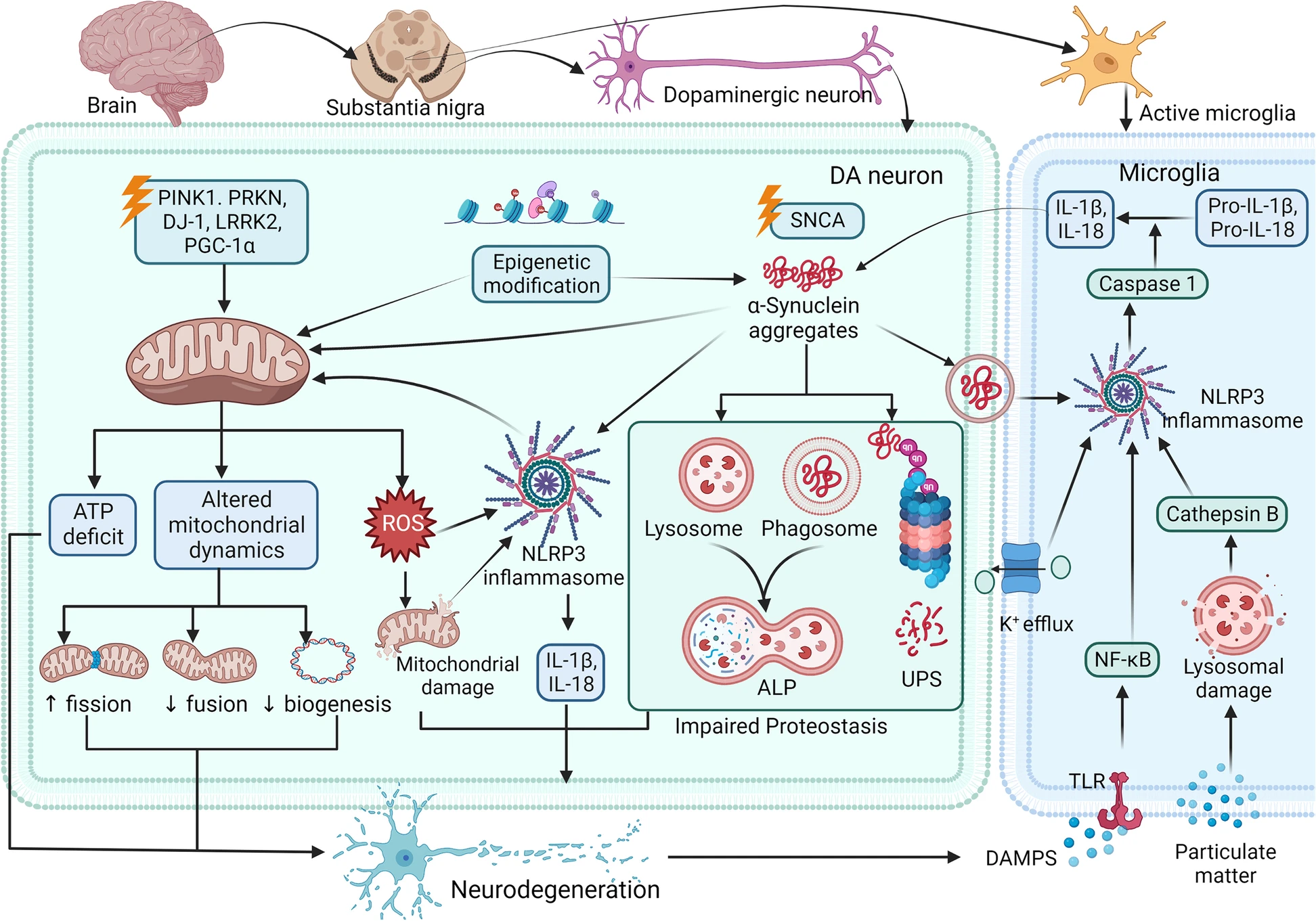
O Parkinson afeta um tipo de neurônio chamado neurônios dopaminérgicos, que são encontrados na região da substância negra do mesencéfalo e são essenciais para movimentos voluntários e processos comportamentais. A grande maioria dos casos de Parkinson ocorre esporadicamente; apenas 10% são herdados geneticamente.
Acredita-se que agregados de proteína ɑ-sinucleína mal dobrada, também conhecidos como corpos de Lewy, estejam envolvidos na fisiopatologia subjacente do Parkinson, e a ɑ-sinucleína é abundante em neurônios dopaminérgicos. A expressão da α-sinucleína também está intimamente ligada ao gene SNCA, que é um dos locais preditivos mais importantes para DP esporádica. A mutação chamada Ala53Thr (A53T) na SNCA é reconhecida como um dos fatores de risco mais proeminentes para DP de início precoce.
Nesse sentido, foi realizado um estudo em 2022, que mostrou que o uso do sistema CRISPR-Cas9 para deletar o gene A53T-SNCA melhorou significativamente as condições relacionadas à doença de Parkinson, como a superprodução de α-sinucleína, microgliose reativa, neurodegeneração dopaminérgica, e sintomas motores associados ao Parkinson.
Na maior parte, porém, as variantes genéticas ligadas à maioria dos casos esporádicos de Parkinson não são claras e os mecanismos moleculares da progressão do Parkinson ainda não foram completamente compreendidos. O desafio de estudar os mecanismos subjacentes do Parkinson é a complexidade das múltiplas mutações genéticas que podem estar envolvidas. Mas esta é também uma área onde o CRISPR pode ser bem utilizado. Pode ajudar a rastrear variantes genéticas no Parkinson para determinar sua causa e pode ser efetivamente usado para desenvolver modelos de pesquisa celular e de organismos inteiros para estudar o fenótipo do Parkinson.
Por exemplo, um estudo conduzido na Universidade de Pittsburgh aproveitou o potencial de edição do genoma da Synthego (que fornece células projetadas e kits CRISPR) para gerar modelos de células nocautes de NADPH oxidase (NOX1, NOX2 e NOX4) para Parkinson. O estudo demonstrou o papel da enzima Nox2 na degeneração relacionada ao estresse oxidativo, incluindo acúmulo de ɑ-sinucleína, comprometimento da importação de proteínas nas mitocôndrias e ativação da quinase 2 de repetição rica em leucina (LRRK2).
Em última análise, neste momento, a maior parte do potencial do CRISPR para a doença de Parkinson reside no rastreio genético, mas isto pode mudar assim que os cientistas começarem a compreender melhor os mecanismos subjacentes à doença neurodegenerativa.
Doença de Huntington: um candidato promissor para terapia genética
Como a doença de Huntington é uma doença neurodegenerativa hereditária causada por uma única mutação e pela presença de uma proteína anormal, torna-a a candidata perfeita para a edição do gene CRISPR. A doença de Huntington é causada por expansões de trinucleotídeos (CAG) no gene Huntingtin (HTT), resultando em longos trechos do aminoácido glutamina na proteína Huntingtina. A hiperexpansão das repetições CAG (40 ou mais) leva ao aparecimento dos sintomas de Huntington.
Um dos estudos CRISPR mais promissores e recentes – realizado no ano passado – para a doença de Huntington, veio de investigadores da Universidade de Jinan. Eles conseguiram demonstrar que a edição CRISPR-Cas9 pode ser usada para corrigir a mutação no HTT, substituindo a hiperexpansão por uma repetição CAG normal. A terapia genética foi empacotada em um vetor AAV e entregue aos porcos por injeção intracraniana ou intravenosa. Um único tratamento resultou na depleção da proteína Huntingtina mutante e na redução da neurotoxicidade e dos sintomas relacionados. Esta pesquisa pré-clínica é muito promissora e poderá progredir para ensaios clínicos.
Outro estudo recente de prova de conceito, que utilizou edição de RNA baseada em CRISPR, de pesquisadores da Johns Hopkins e da UC San Diego, demonstrou uma depleção significativa de transcritos mutantes em três linhas diferentes de células-tronco pluripotentes induzidas (iPSC) derivadas de pacientes com doença de Huntington. , cada um carregando um número diferente de repetições. Experiências in vivo subsequentes num modelo de ratinho com doença de Huntington demonstraram que os ratos tratados melhoraram significativamente a função motora – um efeito que continuou durante até oito meses nos ratos, sugerindo benefícios terapêuticos duradouros.
A razão pela qual os cientistas usaram uma abordagem de edição de RNA baseada em CRISPR neste estudo específico é porque se descobriu que os transcritos de RNA mensageiro mutante (mRNA) produzidos na doença de Huntington contribuem significativamente para a patogênese da doença, o que os torna um bom alvo para o tratamento.
Obstáculos a superar
Como mencionado anteriormente, as doenças neurodegenerativas são complicadas de tratar e, embora o CRISPR se mostre promissor para algumas destas doenças, ainda há um longo caminho a percorrer.
“Os cientistas ainda não compreendem totalmente os mecanismos por trás da maioria das doenças neurodegenerativas”, comentou Buse Baran, analista de operações comerciais e especialista em terapia genética da Er-Kim Pharmaceuticals. “Esta falta de compreensão torna difícil o desenvolvimento de tratamentos direcionados que abordem as causas profundas das doenças. Além disso, as doenças neurodegenerativas normalmente afetam uma ampla gama de células do cérebro, tornando difícil direcionar tratamentos exclusivamente para as células afetadas.”
Ela também acrescentou que a administração de tratamentos ao cérebro é outro desafio significativo porque a barreira hematoencefálica dificulta a passagem da maioria das substâncias para o cérebro, dificultando a administração eficaz dos tratamentos.
CRISPR também ainda é uma tecnologia relativamente nova; aquele que acaba de chegar do seu potencial ao mundo. Baran disse que, embora tenha um grande potencial, ainda requer maior desenvolvimento, e permanecem desafios em torno do risco de efeitos fora do alvo, preocupações éticas, segurança desconhecida a longo prazo e obstáculos de entrega.
No entanto, Baran também observou que a aprovação do CASGEVY e o sucesso demonstrado de um tratamento baseado em CRISPR em ensaios clínicos – em termos de eficácia e segurança – fornecerão uma base positiva para outras potenciais terapias baseadas em CRISPR. “CRISPR é uma tecnologia versátil que se está a tornar cada vez mais eficiente e precisa, capaz de ser utilizada no tratamento de uma vasta gama de doenças…À medida que os dados de eficácia e segurança da tecnologia CRISPR continuam a melhorar, a probabilidade de obtenção de aprovações também aumentará. ”
Assim, à medida que estudos mais bem-sucedidos continuam a ser realizados testando o CRISPR no tratamento de doenças neurodegenerativas, é muito possível que vejamos uma série de tratamentos baseados em CRISPR entrando na clínica para doenças como Alzheimer, Parkinson e Huntington, no próximo futuro. Original em inglês, tradução Google, revisão Hugo. Fonte: Labiotech.