24 May 2021 - Resumo
Normalmente usado para a
doença de Parkinson (DP), a estimulação cerebral profunda (DBS)
produz benefícios clínicos marcantes quando otimizada. No entanto,
avaliar o grande número de configurações de estimulação
possíveis (ou seja, programação) requer várias visitas à
clínica. Aqui, examinamos se a ressonância magnética funcional
(fMRI) pode ser usada para prever as configurações de estimulação
ideais para pacientes individuais. Analisamos os dados de 3 T fMRI
adquiridos prospectivamente como parte de um estudo observacional em
67 pacientes com DP usando configurações de estimulação ideais e
não ideais. A estimulação clinicamente ideal produz um padrão de
resposta cerebral fMRI característico marcado pelo envolvimento
preferencial do circuito motor. Em seguida, construímos um modelo de
aprendizado de máquina prevendo o ideal em comparação com
configurações não ideais usando os padrões de fMRI de 39
pacientes com DP com DBS a priori clinicamente otimizado (88% de
precisão). O modelo prevê configurações de estimulação ideais
em conjuntos de dados invisíveis: pacientes com DP clinicamente
otimizados a priori e sem estimulação. Propomos que as respostas do
cérebro fMRI à estimulação DBS em pacientes com DP podem
representar um biomarcador objetivo da resposta clínica. Após
validação adicional com estudos adicionais, esses achados podem
abrir a porta para a programação de DBS assistida por imagem
funcional.
Introdução
A estimulação cerebral
profunda (DBS) tornou-se um padrão de terapia de tratamento para
distúrbios do movimento, particularmente doença de Parkinson (DP),
tremor essencial e distonia, e está sendo investigada em distúrbios
psiquiátricos e cognitivos, incluindo transtorno depressivo maior e
doença de Alzheimer1,2. DBS envolve a colocação de um eletrodo
para fornecer estimulação elétrica dentro de um circuito neural
disfuncional para suprimir a atividade aberrante e / ou conduzir uma
rede subativa. Apesar de seus benefícios reconhecidos, o mecanismo
terapêutico de ação do DBS permanece incompletamente
compreendido1.
O núcleo subtalâmico (STN), um hub
integral no circuito do motor, é o alvo mais comum no PD-DBS3. O
sucesso do DBS é criticamente dependente da aplicação da dose
apropriada de estimulação no melhor local da região-alvo. A
programação de DBS, o processo de titulação individual da dose de
estimulação elétrica fornecida para alcançar benefícios clínicos
máximos, permanece em grande parte um processo de tentativa e erro
baseado em observações clínicas imediatas e experiência
neurologista4,5. Algumas características clínicas respondem
rapidamente à estimulação elétrica no PD-DBS, por exemplo,
rigidez e, menos previsivelmente, tremor. Para outras deficiências,
incluindo bradicinesia, postura anormal e dificuldades de marcha,
onde pode haver benefícios lentos e progressivos, mas também
efeitos deletérios, a programação empírica representa um desafio
significativo4. Além da DP, a programação é particularmente
difícil em pacientes com DBS para indicações como distonia,
depressão e doença de Alzheimer, em que a resposta ao DBS
normalmente ocorre de forma retardada e pode até estar clinicamente
oculta por semanas a meses após o ajuste do parâmetro. Em cada
caso, a programação do DBS requer várias visitas clínicas
(normalmente a centros de saúde terciários) para testar o grande
número de parâmetros possíveis e descobrir o ambiente que produz o
maior alívio sintomático com o mínimo de efeitos colaterais4. Esse
processo impõe um desgaste significativo de tempo e financeiro aos
pacientes e aos sistemas de saúde6. Portanto, há uma necessidade de
um marcador fisiológico que possa predizer rápida e precisamente a
resposta clínica aos parâmetros DBS e melhorar a eficiência e
diminuir a carga das práticas de programação atuais4.
Os
avanços nas técnicas de neuroimagem aumentaram nossa compreensão
dos efeitos fisiológicos do DBS sobre a atividade dos circuitos
cerebrais (Tabela Suplementar 1). Uma vez que a ressonância
magnética em pacientes com DBS está sujeita a diretrizes de
segurança rígidas7, estudos têm aproveitado conectomas normativos
para investigar retrospectivamente regiões e redes cerebrais cuja
modulação está associada a benefícios clínicos8. A aquisição
de imagens de ressonância magnética funcional prospectiva (fMRI)
nesta população de pacientes tem sido amplamente limitada a estudos
usando hardware de ressonância magnética abaixo do ideal devido a
questões de segurança7. No entanto, avanços recentes estabeleceram
a segurança e a viabilidade do uso de várias sequências de
ressonância magnética em pacientes com DBS7,9 e permitiram um exame
mais detalhado das consequências fisiológicas da aplicação de DBS
em circuitos cerebrais específicos. A fMRI está sendo estudada
agora para investigar as consequências da estimulação nas redes
cerebrais10,11,12,13, mas ainda não foi usada para prever parâmetros
de estimulação DBS ideais nem para aumentar diretamente o potencial
terapêutico do DBS.
Neste trabalho, mostramos que dados prospectivos de fMRI podem identificar padrões de atividade cerebral associados a benefícios clínicos em pacientes com DP, servindo como um biomarcador da eficácia do DBS. Usamos fMRI para (1) identificar um padrão reprodutível do cérebro. Neste trabalho, mostramos que dados prospectivos de fMRI podem identificar padrões de atividade cerebral associados a benefícios clínicos em pacientes com DP, servindo como um biomarcador da eficácia DBS. Usamos fMRI para (1) identificar um padrão reproduzível de resposta do cérebro para estimulação DBS ideal e (2) prever configurações de DBS ideais com base nesses padrões de resposta do cérebro com um algoritmo de aprendizado de máquina (ML). Este algoritmo foi treinado em pacientes com DP já otimizados e testado em dois novos conjuntos de dados: um grupo de pacientes com DP otimizado para estimulação definida clinicamente a priori e um grupo de pacientes com DP sem estimulação.
Resultados
Com base em
publicações anteriores que descrevem a segurança e a viabilidade
da ressonância magnética em pacientes com DBS7,9,14,3 T dados de
fMRI foram adquiridos prospectivamente ao longo de 203 sessões de
fMRI (n = 67 pacientes com PD-DBS, Fig. 1, Tabela 1 ) Uma vez que STN
é o alvo mais comum para DBS no tratamento de DP, recrutamos
principalmente pacientes STN-DBS (n = 62). Também incluímos
pacientes com DBS de globo pálido interno (GPi) (n = 5), que é um
segundo local de estimulação comumente usado, para avaliar se
diferentes alvos de PD-DBS também poderiam contribuir para o modelo
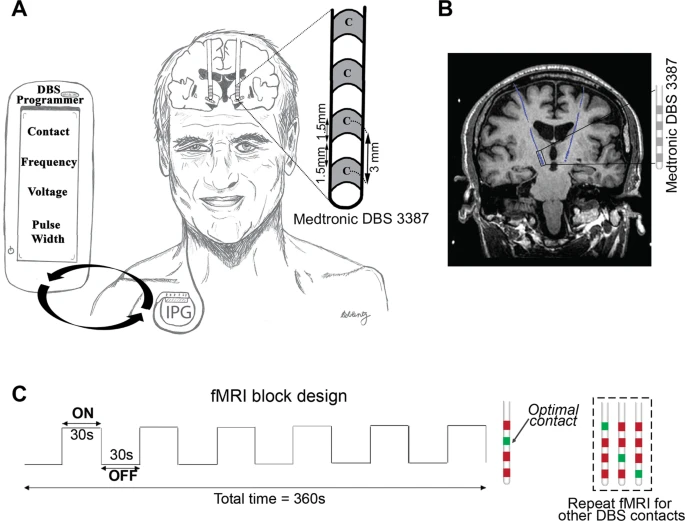
de ML (Tabela 1). Cada sessão teve 6,5 min de duração e empregou
um paradigma de ciclagem DBS-ON / OFF de 30 s repetido seis vezes em
que a estimulação DBS unilateral esquerda foi administrada em
contatos ou tensões específicos do paciente, clinicamente definidos
ideais e não ótimos (Fig. 1C) . Conforme relatado anteriormente15,
isso foi feito para diferenciar entre as alterações do sinal BOLD
unilateral e contralateral, bem como para tentar imitar a programação
do DBS, o que geralmente envolve a avaliação de um eletrodo de cada
vez. Os dados de fMRI adquiridos foram pré-processados usando
um pipeline estabelecido que executou movimento e correção de tempo
de corte (Fig. 2). O sinal dependente do nível de oxigênio no
sangue (BOLD) foi extraído de 16 regiões de interesse motoras e não
motoras (ROIs) determinadas a priori com base na literatura existente
de PET e SPECT16,17,18,19 e nossa experiência com efeitos adversos
(por exemplo, problemas de fala e distúrbios visuais) com
configurações não ideais durante DBS fMRI20. Dado que estudos de
fMRI foram realizados de forma incomum devido a questões de
segurança, PET e SPECT informaram amplamente nossas escolhas de
ROIs. Os valores t absolutos (alterações BOLD) foram normalizados
por valores t médios positivos em áreas presumivelmente envolvidas
em estimulação não ideal. Isso foi feito para comparar os valores
t de DBS-ON de resposta BOLD vs. DBS-OFF de cada ROI entre os
pacientes e para levar em conta os efeitos adversos - uma
consideração importante, dado que o objetivo da programação do
DBS é maximizar os benefícios do motor enquanto minimiza os efeitos
adversos. Alterações BOLD normalizadas (recursos) de 39 pacientes
clinicamente otimizados a priori (n = 35 STN-DBS e n = 4 GPi-DBS) e
sua marcação binária associada (ideal vs. não ideal) foram usados
como entrada para treinar o modelo de ML (Fig. 2, Tabela 1).
Configurações de DBS clinicamente ideais foram obtidas usando
algoritmos publicados4,5. Posteriormente, dois conjuntos de dados
fMRI invisíveis (n = 9 para cada conjunto de dados) - adquiridos com
diferentes contatos ativos ou tensões - foram alimentados no modelo
de ML treinado para fins de validação. A capacidade do modelo para
determinar se uma configuração de DBS era ideal ou não ideal de
acordo com o padrão de fMRI correspondente foi avaliada (Fig. 2).
(segue…) Original em inglês, tradução Google, revisão Hugo.
Fonte: Nature.
Um paciente DBS implantado com eletrodos DBS ativos e totalmente internalizados bilaterais direcionados ao STN. O cabo DBS (Medtronic 3387) tem quatro contatos (largura = 1,5 mm) espaçados 1,5 mm. Usando o programador DBS portátil, a programação DBS envolve a titulação da corrente fornecida ajustando vários parâmetros (isto é, contato do eletrodo, tensão, frequência e largura de pulso) a fim de fornecer o melhor alívio dos sintomas. B Imagem coronal ponderada em T1 demonstrando um paciente com DP com eletrodos DBS totalmente internalizados e ativos (azul) implantados no STN. Paradigma de projeto de bloco C fMRI usado durante a aquisição de dados 3 T fMRI. Enquanto o paciente estava deitado no scanner, a estimulação DBS unilateral (esquerda) foi ligada e desligada a cada 30 s por seis ciclos. O ciclo ON / OFF do DBS foi sincronizado manualmente para a aquisição de fMRI. Cada sequência de fMRI foi adquirida em contatos ou tensões ideais (verde) ou não ideais (vermelho). Neste exemplo, os quatro contatos foram selecionados com fMRI; o contato clinicamente ideal a priori (marcado em verde) e os contatos não ideais (marcado em vermelho) são mostrados. Estimulação cerebral profunda DBS, ressonância magnética funcional fMRI, doença de Parkinson.