090525 - A doença de Parkinson (DP) é uma doença neurodegenerativa caracterizada por uma perda progressiva de neurónios dopaminérgicos na substância negra pars compacta. O stress oxidativo é cada vez mais discutido como um processo-chave no desenvolvimento e progressão da doença. Este é desencadeado e mantido por múltiplos factores, incluindo a disfunção mitocondrial, o metabolismo defeituoso da dopamina e a neuroinflamação crónica. O desequilíbrio resultante entre as espécies reactivas de oxigénio (ERO) e os sistemas de defesa antioxidantes conduz a danos celulares pronunciados, que acabam por provocar a degeneração das células dopaminérgicas. Apesar da investigação intensiva, não existe até à data qualquer terapia curativa. Fonte: medizinonline.
Objetivo: atualização nos dispositivos de “Deep Brain Stimulation” aplicáveis ao parkinson. Abordamos critérios de elegibilidade (devo ou não devo fazer? qual a época adequada?) e inovações como DBS adaptativo (aDBS). Atenção: a partir de maio/20 fui impedido arbitrariamente de compartilhar postagens com o facebook. Com isto este presente blog substituirá o doencadeparkinson PONTO blogspot.com, abrangendo a doença de forma geral.
sexta-feira, 9 de maio de 2025
sexta-feira, 19 de janeiro de 2024
O que vem a seguir na doença de Parkinson?
JANUARY 20, 2024 - Mais de 200 anos desde a publicação de An Essay on the Shaking Palsy (1817), de James Parkinson, permanecem muitas incertezas em relação ao distúrbio neurológico progressivo agora conhecido por seu nome. Esta edição da The Lancet traz nossa primeira série dedicada à doença de Parkinson, que inclui uma exploração de algumas das questões pendentes em torno da epidemiologia, causas e opções atuais de tratamento para esta condição incapacitante e atualmente incurável.
A doença de Parkinson perde apenas para a doença de Alzheimer na lista das doenças neurodegenerativas mais comuns e, com o aumento da esperança de vida e menos causas concorrentes de morte, espera-se que a sua prevalência aumente para 12-17 milhões de pessoas até 2040. Tal aumento exigirá quantidades crescentes de recursos humanos e de cuidados, o que aumentará a pressão já sentida pelos sistemas de saúde a nível mundial. A questão será particularmente grave nos países de baixo e médio rendimento, onde a disponibilidade de tratamentos e terapias de apoio é mais baixa; mesmo nos países de rendimento elevado, tanto os grupos étnicos minoritários como os que vivem nas zonas rurais enfrentam desafios mais amplos no acesso aos cuidados. As dificuldades no diagnóstico da doença de Parkinson (especialmente a doença precoce) também dificultam um tratamento eficaz, e há muita necessidade de uma melhor compreensão das necessidades específicas dos pacientes de minorias étnicas, nos quais as manifestações clínicas e morbidades associadas à doença de Parkinson ainda são pouco descritas.
• Ver conteúdo relacionado a este artigo
Conforme detalhado nos artigos 1 e 2 da Série, a patogênese da doença permanece em grande parte indefinida. A causa da doença de Parkinson é multifatorial e, embora haja consenso entre os especialistas de que a doença de Parkinson é uma doença relacionada com a idade, as questões sobre até que ponto a doença de Parkinson pode ser atribuída a fatores externos (como poluentes) ainda não têm respostas claras.
O Artigo 3 analisa as evidências mais recentes sobre o manejo ideal da doença de Parkinson. Em última análise, a investigação tem de visar tratamentos que possam alterar o curso da doença, mas, apesar do crescente financiamento da investigação, os grandes avanços têm sido poucos e espaçados. A mudança para critérios de base biológica para a classificação da doença de Parkinson está a revelar-se controversa, mas espera-se que estes novos critérios possam ajudar a detectar a doença nas suas fases iniciais, de preferência na fase prodrómica, o que também poderá abrir caminho para futuras investigações sobre a doença. -modificar terapias. Entretanto, estão em curso estudos clínicos de novos medicamentos para melhor tratar a discinesia e outros sintomas motores, assim como ensaios que abrangem vários mecanismos conhecidos da doença de Parkinson. Abordagens não farmacológicas, como a robótica para ajudar com deficiências de marcha e intervenções baseadas em música para ajudar a gerir vários sintomas não motores, também se mostram promissoras. Além disso, o valor potencial das intervenções no estilo de vida para melhorar o controlo dos sintomas de Parkinson não deve ser negligenciado, particularmente no que diz respeito à actividade física e à nutrição, que oferecem alguns meios para levar os cuidados fora da clínica e para casa do paciente.
A maioria dos sistemas de saúde em todo o mundo não está preparada para lidar com a crescente população de pacientes com doença de Parkinson. Apesar da necessidade premente de um melhor acesso a cuidados especializados, ainda há muito a fazer para garantir que os medicamentos essenciais cheguem aos pacientes. Os dados de 2017 mostram que a levodopa e a carbidopa – pilares do tratamento da doença de Parkinson – estavam consistentemente disponíveis em ambientes de cuidados primários em apenas 37 dos 110 países (e apenas três em África e nenhum no Sudeste Asiático). Os cuidadores informais, especialmente as mulheres, continuam a ser essenciais para muitos pacientes com doença de Parkinson, mas as suas experiências são frequentemente ignoradas e há pouco apoio aos cuidadores a nível mundial. Combater o estigma contra a doença (que pode levar a taxas mais elevadas de depressão, comorbidades e mortalidade em indivíduos com Parkinson) e dissipar o equívoco de que a doença de Parkinson é uma consequência natural do envelhecimento pode ser alcançado através da educação e da defesa de direitos – sobretudo entre os profissionais de saúde prestadores de cuidados, especialmente para ajudar a melhorar a comunicação em torno do diagnóstico de Parkinson.
Um tratamento modificador da doença para retardar, interromper e reverter a progressão da doença de Parkinson deve ser o objetivo a ser alcançado. Mas, entretanto, melhorias nos cuidados básicos e especializados para pacientes com doença de Parkinson – apoiando os cuidadores, garantindo o acesso a regimes de medicação simples e expandindo a prestação de cuidados primários e multidisciplinares para comorbilidades – fariam enormes diferenças nos cuidados e na qualidade de vida. para milhões de pacientes em todo o mundo. Original em inglês, tradução Google, revisão Hugo. Fonte: The Lancet.
segunda-feira, 29 de maio de 2023
INVESTIGADOR MADEIRENSE ACREDITA QUE ENTRE 5 A 10 ANOS VÃO SURGIR TRATAMENTOS EFICAZES PARA AS DOENÇAS DE ALZHEIMER E PARKINSON
29/05/2023 - Clévio Nóbrega está confiante de que entre 5 a 10 anos vão surgir tratamentos eficazes para as doenças de Parkinson e Alzeimer.
“As doenças de Alzheimer e Parkinson são um fardo gigante, porque toda a gente conhece alguém ou já ouviu falar de alguém que já teve alguma destas doenças. Nesse campo, e porque já não são doenças nada raras, a investigação é gigante”, notou.
O investigador madeirense na área das neurociências moleculares e da terapia genética lembra que há milhões de cientistas po todo o mundo a trabalhar nessas áreas e, por isso, considera, tendo em conta aquilo que tem lido em revistas cientificas, que “nos próximos cinco a 10 anos vamos ter tratamentos eficazes para estas duas doenças, sobretudo para o Alzheimer”, afirmou.
Note-se que o cientista foi hoje o protagonista a ser distinguido no projeto ‘Madeira – Novos Talentos + Futuro’, que reúne o JM e a Assembleia Legislativa da Madeira, numa parceria que visa destacar e partilhar com a população o talento dos jovens madeirenses a dar cartas nas mais diversas áreas. Fonte: JM.
quinta-feira, 4 de maio de 2023
REVIRAVOLTA DO DESTINO
Um médico-cientista investigou a doença de Parkinson por mais de 30 anos. Agora ele a tem.
4 MAY 2023 - VÁRIOS ANOS ATRÁS, Tim Greenamyre, um neurocientista e médico que dirige o Instituto Pittsburgh para Doenças Neurodegenerativas da Universidade de Pittsburgh (Pitt), começou a notar sintomas inquietantes em seu próprio corpo. Ele não conseguia cheirar as coisas. Ele estava constipado. Ele estava gritando e chutando em seu sono. Seu braço esquerdo não balançava quando ele andava.
Em julho de 2021,
Greenamyre procurou um colega neurologista para confirmar o
diagnóstico que já suspeitava. Ele sofria de Parkinson, doença que
tem se dedicado a tratar e tentar curar. Ao longo de sua longa e
produtiva carreira, o homem de 67 anos não apenas conquistou a
admiração de seus pacientes e colegas clínicos, mas também
desenvolveu um modelo animal amplamente utilizado de Parkinson e
contribuiu com informações importantes sobre os gatilhos
ambientais. Esse trabalho o expôs a produtos químicos que induzem
doenças em roedores, um possível fator de sua própria doença.
“A
ironia é óbvia”, diz Greenamyre, um homem tímido com um senso de
humor seco e uma propensão para piadas práticas que, para o olho
inexperiente, mostra poucos ou nenhum sinal da doença. (Por
enquanto, diz ele, a medicação está ajudando.)
Para os
colegas, a notícia foi chocante e de partir o coração. “Fiquei
tão profundamente afetado que não consegui responder
imediatamente”, diz Laurie Sanders, uma neurocientista que estuda
Parkinson na Duke University School of Medicine e é ex-pós-doutora
de Greenamyre. “Tudo o que eu realmente queria fazer era dirigir
até Pittsburgh e dar um abraço nele.”
Quase todos os cerca
de 200 pacientes de Greenamyre com Parkinson, alguns dos quais ele
cuida há mais de uma década, saberão de seu diagnóstico neste
artigo, no qual ele relutantemente torna sua condição pública
porque está se tornando objeto de rumores. Ele teme que isso os
distraia. “Quero que os visitantes se concentrem neles, não em
mim”, diz ele.
Para agravar a ironia, o diagnóstico de
Greenamyre chega em um momento de novo otimismo entre os
pesquisadores de Parkinson, que acreditam que podem finalmente estar
se aproximando de tratamentos que podem retardar ou interromper a
progressão da segunda doença neurodegenerativa mais comum depois do
Alzheimer. A doença de Parkinson afeta cerca de 1 milhão de pessoas
nos Estados Unidos, com quase 90.000 novos casos diagnosticados a
cada ano. Globalmente, mais de 8,5 milhões de pessoas têm a doença,
que é a doença neurológica que mais cresce no mundo, de acordo com
uma estimativa.
Os sintomas motores clássicos da doença de
Parkinson, descritos em 1817 pelo cirurgião inglês James Parkinson,
resultam da degeneração das células produtoras do neurotransmissor
dopamina na substância negra, área do mesencéfalo envolvida no
controle do movimento. Isso causa uma variedade de sintomas,
incluindo, mais comumente, tremores, rigidez muscular e problemas de
equilíbrio e coordenação. À medida que a doença avança, as
pessoas podem ter dificuldade para falar e iniciar movimentos. Mais
tarde, muitos desenvolvem demência. O Parkinson em si não mata, mas
suas complicações, principalmente a pneumonia por aspiração
devido à dificuldade de engolir, geralmente matam.
A
dopamina, administrada em uma combinação oral de levodopa (L-Dopa)
e carbidopa, tem sido a terapia de primeira linha desde que foi
aprovada nos EUA. na década de 1970, embora permaneça indisponível
ou inacessível para muitos globalmente. A droga melhora os sintomas
motores, mas com o tempo começa a desaparecer mais rapidamente e, às
vezes, efeitos colaterais intoleráveis - incluindo movimentos
involuntários e espasmódicos chamados discinesia - freqüentemente
se desenvolvem. Cinquenta anos depois, o fracasso da ciência em
produzir uma terapia que interrompa a doença em vez de direcionar
seus sintomas tem sido doloroso e frustrante para os pacientes e suas
famílias.
Mas agora, "estamos em um ponto de inflexão",
diz Todd Sherer, um neurocientista e ex-pós-doutorado de Greenamyre
que dirigiu a Fundação Michael J. Fox para Pesquisa de Parkinson
até 2021 e agora é seu diretor de missão. Esse otimismo é fruto
de décadas de pesquisas, aceleradas pelas revelações, a partir de
1997, de mutações genéticas ligadas à doença. Essas descobertas
abriram as portas para que cientistas, incluindo Greenamyre,
investigassem os mecanismos moleculares da doença, resultando em uma
enxurrada de publicações (veja o gráfico - na fonte). O novo conhecimento,
por sua vez, permitiu que as empresas desenvolvessem medicamentos e
outras terapias experimentais que visam retardar, parar ou mesmo
prevenir a doença (ver gráfico - na fonte). Hoje essas terapias estão
entrando em ensaios clínicos em um ritmo impressionante.
“Houve
uma mudança porque estamos entendendo melhor a doença e os alvos”,
diz Sanders, observando que mais de 50 ensaios clínicos atacando as
raízes da doença estão em andamento. É um aumento extraordinário,
diz ela, em relação ao punhado que estava em andamento quando ela
começou na área, 15 anos atrás.
Apesar desses sinais
esperançosos, os avanços antecipados podem chegar tarde demais para
Greenamyre e seus pacientes com Parkinson. No momento em que a doença
é diagnosticada por meio de uma mão trêmula ou um pé arrastando,
acredita-se que ela esteja ativa há décadas, causando os sintomas
mais silenciosos, como constipação e perda do olfato que Greenamyre
experimentou - e destruindo cerca de metade da neurônios produtores
de dopamina na substância negra. Mas Greenamyre continua determinado
a acabar com a doença.
"Não há um bom momento para ser
diagnosticado com a doença de Parkinson", disse ele no outono
passado, quando ganhou um prêmio de US$ 100.000 pela liderança em
pesquisa da fundação Fox. “Mas este é o melhor momento da
história para ser diagnosticado com a doença de
Parkinson.”
GREENAMYRE CRESCEU no Condado de Westchester, em
Nova York, filho de um engenheiro químico e de uma dona de casa. Na
faculdade de medicina da Universidade de Michigan, uma de suas
primeiras professoras foi a médica Anne Buckingham Young, uma
entusiasmada nova professora assistente que Greenamyre lembra como
uma “força da natureza”. Como Young descreveu seu Ph.D. trabalho
iluminando como o veneno estricnina exerce seus efeitos nos
receptores para o neurotransmissor glicina na medula espinhal,
Greenamyre ficou extasiado. “Achei muito legal o espaço em que ela
estava, onde ela poderia falar sobre mecanismos farmacológicos e
fisiológicos básicos que têm implicações clínicas”, diz ele.
Ele se juntou ao laboratório dela e desenvolveu uma técnica para
visualizar os receptores de neurotransmissores no cérebro, que ele e
Young usaram para investigar os mecanismos das doenças de Alzheimer
e Huntington. Ele ganhou tanto um M.D. e Ph.D., e em 1990, quando
começou a administrar seu próprio laboratório e a atender
pacientes em uma clínica de distúrbios do movimento de alto nível
na Universidade de Rochester, ele foi co-autor de 20 artigos, dois
deles na Science.
Ele também começou a estudar a doença de
Parkinson. Como outros na área, ele foi inspirado por um artigo da
Science de 1983 que descrevia um grupo surpreendente de jovens com
Parkinson de início súbito que apareceram em hospitais do norte da
Califórnia. Todos haviam ingerido uma droga de rua contaminada com
uma substância química chamada MPTP. Seu metabólito tóxico, MPP+,
destruiu os neurônios dopaminérgicos na substância negra, e os
cientistas logo mostraram que o MPP+ atua e inibe o complexo I, a
primeira enzima em uma cadeia bioquímica crucial que converte
alimentos em energia nas mitocôndrias, as minúsculas usinas de
força dentro das células. . Foi uma pista tentadora de que o dano
mitocondrial pode desempenhar um papel na doença.
Greenamyre
e outros sabiam que o MPP+ não era o único inibidor do complexo I.
Havia muitos, incluindo alguns produtos químicos que os estudos
estavam começando a implicar na doença de Parkinson. Mas o inibidor
clássico dessa enzima mitocondrial vital era um pesticida usado por
horticultores domésticos chamado rotenona.
A rotenona era
considerada um inseticida "orgânico" porque era derivada
das raízes de certas plantas; As pessoas também o usavam para matar
pulgas e carrapatos em seus animais de estimação, e as agências de
vida selvagem o usavam para controlar populações de peixes
invasores. Mas para Greenamyre, era uma maneira de desvendar os
mistérios do Parkinson. Em 1990, ele começou a usar rotenona
radiomarcada, uma substância química que adora gordura e atravessa
facilmente as membranas biológicas, incluindo a barreira
hematoencefálica, para mapear localizações no cérebro do complexo
I.
Na mesma época, vários laboratórios encontraram
evidências em amostras cerebrais pós-morte, bem como em plaquetas
de pacientes, de que pessoas com doença de Parkinson apresentavam
atividade defeituosa do complexo I em suas mitocôndrias. Greenamyre
percebeu que poderia imitar a doença em ratos expondo-os à
rotenona. Ele esperava que o produto químico adicionasse
mitocôndrias em todos os órgãos. E aconteceu. Mas teve efeitos
tóxicos descomunais em apenas um tipo de célula.
Em 2000, Greenamyre, que na época estava na Emory University, e sua equipe publicaram um artigo seminal na Nature Neuroscience. Eles relataram que dar aos ratos uma infusão intravenosa crônica de rotenona destruiu seletivamente os mesmos neurônios produtores de dopamina na substância negra que degeneram em pacientes com Parkinson. Além disso, os neurônios sobreviventes continham fibrilas, ou fios minúsculos, da proteína alfa-sinucleína, agregadas em aglomerados. Essas agregações se assemelhavam muito a estruturas chamadas corpos de Lewy, que são uma assinatura do Parkinson no cérebro humano. Além disso, os ratos desenvolveram sintomas parkinsonianos: movimentos instáveis e posturas curvadas, patas trêmulas e rigidez severa.
O trabalho deu aos pesquisadores o primeiro modelo
animal que capturou tanto os sintomas motores clássicos quanto a
patologia característica da doença. Também aumentou as suspeitas
de que a rotenona e outros pesticidas poderiam desencadear o Parkinson.
HOJE, GREENAMYRE se pergunta se suas décadas de
pesquisa com rotenona e compostos semelhantes podem ter causado sua
doença. “Como não sabíamos tanto, não fomos tão cuidadosos”,
diz ele. “E eu fui exposto a coisas, e particularmente rotenona,
bastante.”
É fevereiro e Greenamyre está refletindo em voz
alta sobre uma tigela de almoço com arroz, espinafre e queijo de
cabra em seu escritório iluminado pelo sol, que fica ao lado de seu
laboratório no coração do campus médico de Pitt no centro da
cidade. Ele acabou de chegar de uma reunião de laboratório onde a
neurocientista Emily Rocha, uma ex-pós-doutora, apresentou um
desafio complicado que ela encontrou em sua pesquisa e uma parada
para examinar algumas imagens recém-coletadas de neurônios
dopaminérgicos com o estudante de pós-graduação Matthew Keeney.
Ex-alunos de pós-graduação e pós-doutorandos dizem que Greenamyre
tem um estilo de orientação encorajador, mas não participativo.
“Ele tinha uma grande capacidade de deixar você explorar, mas
sabia quando puxá-lo de volta quando você estava caindo na toca do
coelho”, lembra Sherer.
Durante o almoço, Greenamyre
explica que a rotenona deve ser dissolvida em um solvente como
dimetil sulfóxido (DMSO) para fazer uma solução infusível. Essa
solução derramava em suas luvas de vez em quando, e “o DMSO passa
direto pelas luvas e entra na sua pele e direto na sua pele”. Ele
não deu muita importância na época, diz ele, porque ele e seus
colegas realmente não achavam que havia muito perigo. “Até que
fizemos uma pequena pesquisa sobre isso”, acrescenta ele. (Um
estudo epidemiológico de alta qualidade publicado em 2011 associou o
uso de rotenona a um aumento de 2,5 vezes no risco de desenvolver a
doença de Parkinson em agricultores e seus cônjuges.)
Se a
rotenona desempenhou um papel na causa da doença de Greenamyre,
provavelmente se somou às vulnerabilidades genéticas subjacentes.
Ele é um dos 90% das pessoas com a chamada doença idiopática: seu
Parkinson não tem causa genética clara, mas quase certamente
resulta de alguma combinação de suscetibilidades genéticas mal
definidas e gatilhos ambientais. Greenamyre, por exemplo, já teve
cabelos ruivos, que estudos epidemiológicos associaram a um risco
elevado de Parkinson. (Por que isso pode ser não é
compreendido.)
Cerca de 10% dos casos de Parkinson, no
entanto, são claramente devidos a mutações em genes específicos.
Depois que uma publicação da Science em 1997 identificou o primeiro
deles, no gene da alfassinucleína, muitos cientistas se concentraram
nos genes e apenas nos genes. Logo eles descobriram mais mutações
herdadas – em genes que codificam uma proteína chamada Parkin, uma
enzima chamada LRRK2 e outra enzima, a glucocerebrosidase. Os
pesquisadores começaram a detalhar como os genes mutantes estavam
causando seus danos.
Essas descobertas coincidiram com um
período complicado na vida pessoal de Greenamyre. Um divórcio
difícil levou à sua mudança de Emory para Pitt em 2004. Ele também
enfrentou problemas de financiamento. O principal financiador de
Greenamyre na época, a Fundação Picower, havia investido dezenas
de milhões com Bernie Madoff, o notório operador do esquema Ponzi;
estava tudo perdido. “Qualquer coisa acima de US$ 20 é bem-vinda”,
disse Greenamyre ao Neurology Today em 2009, quando perguntado como
ele manteria seu laboratório de 13 membros funcionando.
Apesar
desses obstáculos, Greenamyre passou os últimos 20 anos tentando
definir os mecanismos críticos que destroem os neurônios no
Parkinson, em vez de perseguir novos genes causadores como muitos
outros fizeram. Ele se concentrou na complicada dança entre os genes
e o meio ambiente, com ênfase em pesticidas e solventes que
interagem com os principais genes associados ao Parkinson.
Nos
últimos anos, Greenamyre se concentrou em LRRK2 (pronuncia-se
“lark 2”), que significa leucine-rich repeat kinase 2. A
enzima que ele codifica é um controlador mestre de tráfego,
regulando o movimento de proteínas e compartimentos chamados
vesículas dentro células. Várias mutações no gene colocam a
atividade da enzima em overdrive. Isso acaba prejudicando a função
dos lisossomos, os coletores de lixo celular que degradam proteínas
indesejadas, e acredita-se que o dano contribua para a doença.
“Estes foram os primeiros dados em tecidos reais de pacientes demonstrando … em pacientes com doença de Parkinson idiopática que eles têm aumento da atividade da quinase LRRK2”, diz Carole Ho, diretora médica e chefe de desenvolvimento da Denali Therapeutics.
O artigo
sugere fortemente que a inibição dessa atividade pode ajudar muitos
pacientes – e não apenas os 3% a 4% que abrigam mutações LRRK2
herdadas. Em ratos que receberam rotenona, descobriram os
pesquisadores, um inibidor de LRRK2 bloqueou todos os eventos
anormais normalmente causados pelo pesticida. A descoberta deu
um novo impulso aos esforços das empresas para testar os inibidores
LRRK2 em pessoas; O candidato de Denali é o mais adiantado. Ela fez
parceria com a Biogen, que agora está registrando mais de 1.000
pacientes com Parkinson com e sem mutações LRRK2 para ver se um
inibidor da enzima retarda a progressão da doença.
Laboratórios
e ensaios clínicos em todo o mundo estão buscando outras drogas,
terapia genética e células-tronco para substituir os neurônios
dopaminérgicos perdidos. Alguns alvos demonstraram culpados
biológicos, por exemplo, aumentando a atividade da enzima
glucocerebrosidase, que pode ser suprimida na doença de Parkinson,
ou bloqueando a agregação de alfa-sinucleína tóxica. Outros visam
dar munição geral ao cérebro, como ferramentas farmacológicas
para melhor reparo e manutenção dos neurônios
dopaminérgicos.
Houve decepções iniciais. Em 2021 e 2022,
respectivamente, a Biogen e a AbbVie encerraram os ensaios clínicos
de anticorpos que atacam a alfassinucleína. A Roche e a Prothena
Biosciences estão avançando, apesar dos resultados igualmente
decepcionantes dos testes no verão passado, mostrando que seu
anticorpo monoclonal, prasinezumab, não teve impacto significativo
na progressão da doença.
Muitos pesquisadores esperam que
essas falhas visíveis se tornem mais raras. A biologia subjacente do
Parkinson varia amplamente entre os subconjuntos de pacientes, e
esforços estão em andamento para combinar as pessoas certas com os
testes certos, para que cada terapia seja testada naqueles com maior
probabilidade de responder a ela.
Identificar pessoas em risco
muito antes de os sintomas motores aparecerem também pode ajudar.
Anticorpos para alfa-sinucleína ainda podem funcionar, por exemplo,
se administrados cedo o suficiente, antes da extensa perda de
neurônios. A fundação Fox está realizando um grande estudo de
longo prazo em busca de marcadores de imagem, biológicos e genéticos
que possam detectar pessoas nos estágios iniciais da doença. Esse
estudo produziu resultados marcantes no mês passado: um relatório
no The Lancet Neurology descobriu que um teste de punção lombar
para alfassinucleína mal dobrada no fluido que banha a medula
espinhal diagnosticou com precisão o Parkinson em 88% das vezes,
inclusive identificando-o antes que as pessoas começassem a ter
sintomas motores. Embora a capacidade de invasão do teste torne
improvável seu uso rotineiro, será uma ferramenta valiosa para
selecionar pacientes para ensaios clínicos e investigar a biologia
da doença, dizem os cientistas. E um exame de sangue semelhante, se
os resultados iniciais promissores confirmarem, pode estar disponível
no momento em que as terapias estiverem prontas para tratar a doença
em estágio inicial.
DEPOIS DE MESES se preocupando com sua
própria falta de olfato e outros sintomas, Greenamyre finalmente
recorreu a um colega de confiança, Edward Burton, um neurologista de
Pitt e neurocientista que estuda o Parkinson. Burton diz que
às vezes fica sobrecarregado com seu treinamento; ele analisa as
pessoas sem querer, com um olhar habilmente atento às mais sutis
anormalidades do movimento.
No verão de 2019, Burton estava
voltando de uma Conferência de Pesquisa Gordon sobre a Doença de
Parkinson presidida por Greenamyre, e a dupla estava sentada no
saguão de um aeroporto. Alguém mais fez uma pergunta a Greenamyre,
e Burton pensou que a cabeça de seu amigo se voltou para o
questionador um pouco devagar demais.
Logo depois, a pandemia
de COVID-19 desceu e Burton não viu seu colega por quase 2 anos.
Então, em julho de 2021, quando os dois homens estavam de volta ao
laboratório e à clínica, Greenamyre pediu a Burton que se
encontrasse confidencialmente com ele.
“Ele estava
claramente muito preocupado”, lembra Burton. (Greenamyre deu
permissão a Burton para discutir seu caso para este artigo). RBD é
um sintoma precoce da doença de Parkinson, mas também pode ser um
prenúncio de doenças neurodegenerativas mais raras e rapidamente
progressivas.
Burton ouviu
atentamente o relato de seu amigo sobre seus sintomas e, em seguida,
aplicou-lhe os mesmos testes motores que Greenamyre havia aplicado a
seus próprios pacientes inúmeras vezes. Quando Greenamyre tentou
abrir e fechar rapidamente seus dedos indicadores e polegares, sua
mão esquerda falhou sutilmente. Burton já havia notado em passagens
casuais no corredor que o andar de seu colega era assimétrico; ele
não estava balançando o braço esquerdo como fazia com o
direito.
“Por ser alguém de quem gosto muito e respeito
muito, examiná-lo, cada sinal físico era como ter meu estômago
arrancado”, lembra Burton.
Os sintomas de Greenamyre e a
lenta progressão de sua doença levaram Burton a concluir que
provavelmente era Parkinson e não algo ainda pior. Ele iniciou a
terapia com dopamina para Greenamyre e seus sintomas melhoraram
rapidamente, confirmando o diagnóstico.
“Houve alguma
lentidão. E isso mudou totalmente”, lembra a parceira de
Greenamyre, a neurocientista Teresa Hastings, de Pitt. “Toda a
postura dele pareceu mudar quando ele começou a tomar L-Dopa. É
como se seus músculos estivessem ajustados.”
Quando a
entrevista terminou naquele dia de verão de 2021, Greenamyre
estendeu a mão para apertar a mão de Burton. “Ele me agradeceu
por avaliá-lo”, diz Burton. “Tim realmente lidou com isso com
dignidade e desenvoltura.”
EM UM INTERVALO entre os
pacientes em fevereiro, o tipicamente reservado Greenamyre admitiu
algumas preocupações sobre o que vem a seguir. “Quando tenho
alguma sensação estranha ou algo assim - você sabe, todo mundo tem
essas coisas. Mas agora você se pergunta se isso faz parte da
doença... um formigamento aqui ou ali.”
Ainda assim, ele
continua otimista, como quando seu paciente Hannan perguntou se uma
terapia melhor estava finalmente surgindo. “Acho que estamos
chegando ao cerne da questão. Mas não está pronto para o horário
nobre”, disse Greenamyre. “As coisas estão um pouco além do
horizonte.” Original em inglês, tradução Google, revisão Hugo.
Fonte: Science.
quinta-feira, 4 de março de 2021
Um ano agitado pela frente para a doença de Parkinson
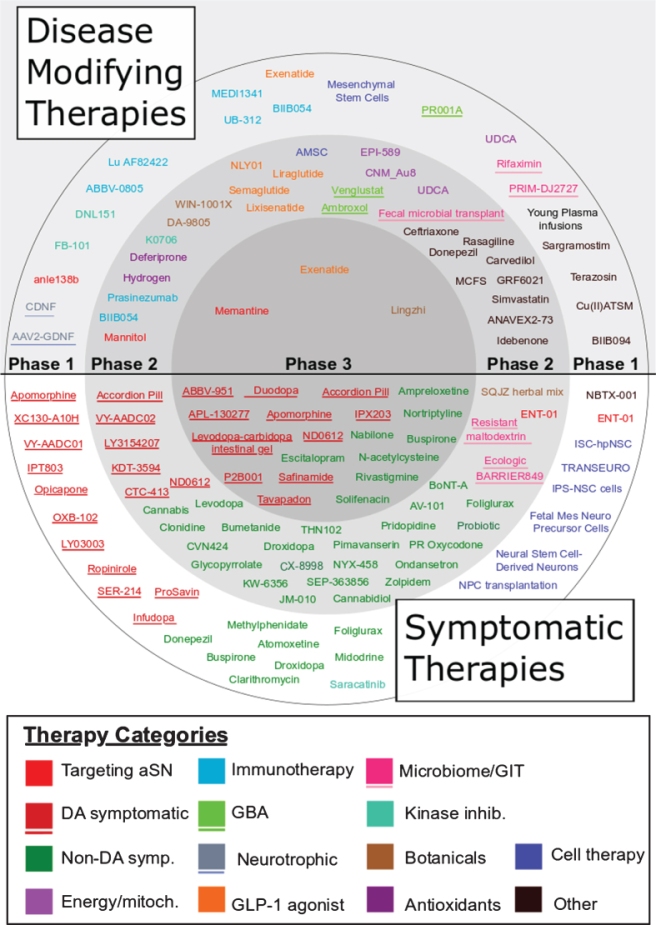
March 03, 2021 - À medida que várias grandes empresas farmacêuticas abandonam os projetos de Parkinson, a atenção se volta para as terapias genéticas e o reaproveitamento de medicamentos para diabetes.
A pesquisa da doença de Parkinson terminou em vários becos sem saída, apesar dos esforços substanciais ao longo de muitos anos. Recentemente, a Biogen e a Sanofi descartaram seus candidatos ao Parkinson, cipanemabe e venglustato, respectivamente, devido à falta de eficácia, e uma terapia modificadora da doença ainda não se materializou.
Mas o esforço para encontrar drogas que
ajudem a reduzir os sintomas continua, e o Evaluate Vantage se
aprofundou no pipeline de projetos em testes clínicos em estágio
avançado. Este ano parece ser crucial para o campo, com 10 estudos
previstos para produzir dados ou serem concluídos em 2021.
Um
alvo que surge várias vezes é o GLP-1; esta abordagem,
tradicionalmente empregada no diabetes tipo 2, também está sendo
testada na doença de Alzheimer. Entre outras vias de pesquisa,
espera-se que a terapia genética possa oferecer uma cura única para
o Parkinson.
Reaproveitamento
A pesquisa
sugeriu que os agonistas de GLP-1 têm benefícios neuroprotetores, e
vários ensaios de medicamentos para diabetes comercializados, bem
como novos projetos de direcionamento de GLP-1, estão em andamento
no Parkinson. Alguns desses estudos são patrocinados pelo
investigador, incluindo o mais avançado, um ensaio de fase III
executado por UCL do Bydureon da Astrazeneca denominado
Exenatide-PD3.
Este estudo tem como objetivo desenvolver
um ensaio anterior do mesmo grupo de pesquisa que mostrou que, em 60
semanas, as pontuações sem medicação na escala de classificação
MDS-UPDRS melhoraram 1,0 ponto no grupo da exenatida e pioraram 2,1
pontos no placebo coorte. Os resultados estão um pouco distantes,
com a data de conclusão primária de Clintrials.gov de Exenatida-PD3
em 2023.
Nesse ínterim, são esperados dados de vários
estudos de fase II de agonistas GLP-1, incluindo um ensaio de Victoza
da Novo Nordisk, administrado pela Cedars-Sinai Medical em
colaboração com a empresa dinamarquesa e The Cure Parkinson's
Trust. Esse estudo deve ser concluído em setembro.
Setembro
também verá a conclusão de um teste intermediário da formulação
PT320 de exenatida de liberação sustentada da Peptron.
Neuraly
também está avaliando uma nova formulação de exenatida, desta vez
uma versão peguilada; A peguilação aumenta a permeabilidade
através da barreira hematoencefálica. Esse projeto está mais atrás
do Peptron, com seu teste de fase II definido para ser concluído no
próximo ano.
Terapias genéticas
Embora as
terapias genéticas possam oferecer uma solução de longo prazo,
esta abordagem sofreu seu quinhão de contratempos recentemente, e a
doença de Parkinson não foi exceção: o VY-AADC da Voyager foi
colocado em espera clínica em dezembro depois que anormalidades
foram vistas em exames de ressonância magnética dos pacientes . A
Neurocrine, parceira da Voyager, posteriormente abandonou o
projeto.
Outros grupos que esperam um resultado melhor
incluem Sio Gene Therapies with AXO-Lenti-PD, um projeto de vetor
lentiviral projetado para restaurar os níveis de dopamina por meio
da entrega de três genes necessários para a síntese de dopamina. A
esperança é que isso estabilize a doença e reduza a medicação
L-dopa; ainda assim, o ativo é uma versão atualizada do Prosavin da
Oxford Biomedica, que gerou eficácia fraca e foi finalmente
abandonado.
Nas primeiras duas coortes do estudo de fase
II Sunrise-PD, AXO-Lenti-PD levou a melhorias promissoras na
pontuação “off” da Parte III UPDRS, embora em um número muito
pequeno de pacientes.
O projeto foi atingido por atrasos
de fabricação, no entanto, e os processos para fornecer material de
ensaio clínico para estudos maiores ainda não foram
finalizados.
Grandes grupos farmacêuticos também estão
se envolvendo em terapia genética, mais recentemente a Lilly, que
comprou o Prevail em dezembro passado por $ 880 milhões à vista,
ganhando o candidato a Parkinson PR001. O projeto baseado em AAV visa
transferir o gene GBA1 que codifica a enzima beta-glucocerebrosidase,
necessária para o descarte e reciclagem de glicolipídios. Estima-se
que cerca de 7 a 10% dos pacientes com Parkinson em todo o mundo
carreguem pelo menos uma mutação GBA1.
O teste de fase I
/ II do Propel do PR001 está em andamento e, antes da aquisição da
Prevail, a empresa disse que forneceria biomarcadores e análises de
segurança em um subconjunto de pacientes em meados de 2021.
Outros
acordos em estágio inicial, como a mudança de Abbvie para
encurralar o pesquisador pré-clínico Mitokinin ontem, mostram que
as grandes empresas também estão interessadas em explorar outras
tecnologias inovadoras.
Com uma lista de chamada
respeitável de testes em estágio final se preparando para a
leitura, os próximos anos trarão passos maiores nesta doença.
Original em inglês, tradução Google, revisão Hugo. Fonte:
Evaluate Vantage.
Segue extrato de tabela com os medicamentose em perspectiva (tabela completa na fonte):
segunda-feira, 21 de dezembro de 2020
Perspectivas, tratamentos atuais e terapias de modificação
Extrato de artigo sobre as perspectivas de tratamentos mais eficazes publicado no início de 2020, que considero um ano praticamente perdido para a covid-19, portanto tudo adiado sine die.
Aqui no SoPD (scienceofparkinsons), estamos principalmente interessados na modificação da doença de Parkinson. Embora haja uma grande quantidade de pesquisas interessantes explorando as causas da doença, novas terapias sintomáticas e outros aspectos do Parkinson, meu foco é geralmente na ciência que busca desacelerar, parar ou reverter a condição.
No início de cada ano, é uma prática útil traçar o que está planejado e o que estaremos procurando nos próximos 12 meses. Obviamente, onde 2020 realmente terminará é imprevisível (veja a covid-19), mas um esboço do que está programado para o próximo ano nos fornecerá um recurso útil para gerenciar melhor as expectativas.
Neste post, tentarei expor um pouco do que 2020 reserva para nós no que diz respeito à pesquisa clínica focada na modificação da doença de Parkinson.
Meu antigo mestre escoteiro uma vez olhou em volta de nosso círculo em forma de ferradura, fazendo contato visual com cada um de nós, antes de fazer a pergunta:
“Quando Noé construiu a arca?”
Meus colegas escoteiros e eu nos entreolhamos - confusos. Ele queria uma data exata?!?
O chefe escoteiro esperou um momento para um de nós oferecer alguma tentativa idiota de uma resposta - felizmente ninguém o fez - antes de dizer solenemente:
“Antes da chuva”
Foi um daqueles momentos de infância que faziam pouco sentido na época, mas volta a assombrá-lo quando adulto quando você olha para o que o futuro pode trazer e tenta planejá-lo.
# # # # # # # # # # # #
A postagem de hoje é o nosso esforço anual de varredura do horizonte, onde apresentamos o que está previsto para os próximos 12 meses no que diz respeito à pesquisa clínica focada na modificação da doença de Parkinson.
Também mencionaremos brevemente outras partes do trabalho pré-clínico que estamos observando para qualquer notícia de desenvolvimento.
Para ser claro, esta postagem NÃO pretende ser um exercício de leitura de folhas de chá (N.T.: ou borra de café no fundo da xícara, ou seja, quiromancia)- nenhuma previsão será feita aqui. Também não é um guia definitivo ou exaustivo do que o próximo ano reserva para a pesquisa de modificação de doenças (se você vir algo importante que esqueci - entre em contato comigo). E certamente não se deve presumir que qualquer um dos tratamentos mencionados abaixo serão balas de prata ou elixires mágicos que irão “curar” a doença.
Na introdução às perspectivas do ano passado, escrevi sobre os perigos de ter expectativas (clique aqui para ler essa postagem). Não vou repetir essa introdução aqui, mas que a mesma mensagem se aplica quando olhamos para o que 2020 nos reserva.
Na verdade, no meu entender, isto provavelmente se aplica ainda mais a 2020 do que a 2019. (N.T.: eu diria 2022!)
2020 será um ano agitado para a pesquisa sobre Parkinson, e estou genuinamente preocupado com o fato de que postagens como esta só irão aumentar as expectativas. Minha esperança é que um melhor entendimento de onde as coisas estão atualmente e o que está programado para os próximos 12 meses ajude a gerenciar melhor essas expectativas. Por favor, entenda que ainda há um longo caminho a percorrer para todas essas terapias experimentais.
Dito isso, vamos começar:
Conforme declarado na introdução, irei me concentrar principalmente em ensaios clínicos de terapias experimentais potencialmente modificadoras de doenças neste post, já que uma discussão mais ampla de "todas as pesquisas sobre Parkinson em 2020" é uma tarefa muito maior.
E de acordo com as perspectivas dos anos anteriores, vou enquadrar esta discussão em torno da ideia de que:
Qualquer "terapia curativa" para o mal de Parkinson vai exigir três componentes principais:
Um mecanismo de detenção de doenças
Um agente neuroprotetor
Alguma forma de terapia restauradora
Agora, a má notícia é (até onde eu sei) não existe um único tratamento disponível (ou sendo testado) que pode fazer todas essas três coisas. Com isso, quero dizer que não existe terapia de mecanismo de detenção de doenças que também possa substituir células cerebrais perdidas. Nem existe uma terapia restauradora que interrompa a progressão da doença.
Essa declaração pode obviamente ser lida como uma má notícia, mas não deveria.
Deixe-me explicar:
Uma terapia curativa para o Parkinson precisará ser personalizada para cada indivíduo, com níveis variáveis de cada um dos três componentes listados acima. Será uma abordagem multimodal projetada para as necessidades de cada indivíduo.
Com isso, quero dizer que há uma grande heterogeneidade (ou variabilidade) entre os indivíduos no que diz respeito aos seus sintomas e ao tempo que eles têm a doença. Algumas pessoas são mais dominantes do tremor, enquanto outras não têm nenhum tremor. Da mesma forma, alguns indivíduos acabaram de ser diagnosticados, enquanto outros viveram com a doença por muitos anos.
As necessidades de tratamento de cada indivíduo serão diferentes e, portanto, o que iremos exigir são diferentes quantidades do componente do mecanismo de detenção da doença, do componente de neuroproteção e dos componentes da terapia restauradora para cada pessoa afetada.
sexta-feira, 13 de dezembro de 2019
Estimulação de alta frequência do núcleo subtalâmico para o tratamento da doença de Parkinson - uma perspectiva de equipe
Manjit K. Sanghera; J. Michael Desaloms; R. Malcolm Stewart
DISCLOSURES J Neurosci Nurs. 2004;36(6):301-311.
Abstract and Introduction
Parkinson's disease (PD) is a debilitating neuro degenerative disorder affecting more than 1.2 million people in the United States. Genetic and environmental toxins are believed to be risk factors in acquiring the disease. PD is characterized by tremors, rigidity, bradykinesia, poor gait, and postural instability. These cardinal symptoms improve with medication such a levo-dopa (L-dopa). However, over time, as the disease progresses, the patient becomes refractory to medication, or medication produces debilitating side effects. When this occurs or when there are worsening of symptoms, neurosurgical treatment is recommended, particularly deep brain stimulating (DBS) electrodes implanted in the subcortical subthalamic nucleus (STN). Over the last 5 years STN DBS has gained acceptance and become the neurosurgical treatment of choice for PD. To achieve maximum beneficial effects with minimum adverse effects from the surgery, the expertise of an integrated team of physicians and nurses is essential. A clear understanding of the different aspects of the procedure,including the risks and benefits of the treatment, assists neuroscience nurses in communicating with the PD patient, and providing the most appropriate,knowledge-based pre- and postoperative care.
Parkinson's disease (PD) is a neurodegenerative disorder affecting over 1.2 million people in the United States. Most patients are older than 50 years, but 10% are younger than 50. The etiology of PD is multifactorial with genetic and environmental factors combining to reduce dopamine levels in the basal ganglia (Baldereschi etal., 2003; Gasser, 2001; Scott et al., 2001; Tsang & Soong, 2003). The disease is characterized by tremors, rigidity, bradykinesia, postural instability, and gait disability. Some of these cardinal symptoms can be improved by medication such a levo-dopa (L-dopa). However, as the disease progresses, the medication becomes less effective or produces debilitating side effects. The failure of medical therapy to provide long-lasting relief of symptoms, along with improvement in neuro imaging and neurosurgical stereotactic technique, has prompted a resurgence in the surgical approaches for the treatment of PD. One neurosurgical treatment for PD involves high-frequency stimulation of the subthalamic nucleus (STN). This is achieved through a deep brain stimulating (DBS) electrode implanted in the STN, a small structure (10 x 10.7 x 7 mm; Bejjani et al., 2000) buried deep in the subcortex.
This neurosurgical procedure is gaining increasing acceptance. Significant improvement in motor symptoms is reported, as well as a significant reduction in dopaminergic medication with a consequent improvement or elimination of L-dopainduced dyskinesias (Krack et al., 2003). As this cost-effective and reversible procedure becomes the standard neurosurgical treatment of choice for PD, nurses play a pivotal role in the management of pre- and postoperative care of PD patients.
This article reviews the preoperative and immediate postoperative aspects of STN DBS and reports on our experiences with this technique. Seventy-eight DBS STN surgeries (i.e., 48 simultaneous bilateral, 22 staged bilateral, and 8 unilateral) were performed at Presbyterian Hospital of Dallas (PHD) with no mortality and no long-term morbidity. Nearly all patients have had their united PD rating scale (UPDRS) lowered by an average 30%; the medication has been reduced by 30%-60%; and four patients are completely off medication. The long-term effects of DBS for motor symptoms continue to be positive, but the progression of the nonmotor symptoms, particularly behavioral ones, continues over time.
The degree of benefit obtained is critically dependent on a number of factors such as (a) selecting the ideal patient, (b) timing the surgery, (c) precisely localizing and implanting a DBS electrode at the target site, (d) programming the stimulator to alleviate motor symptoms while reducing adverse effects of stimulation, and (e) providing appropriate postoperative care. By careful optimization of all these variables attained by the interaction of a team comprising a neurosurgeon, neurologist, neurophysiologist, anesthesiologist, operating room nurses, nurse practitioners,and outpatient nurses, it is possible to obtain excellent outcomes with few to no immediate adverse effects. (segue...) Fonte: MedScape.