Oct 16, 2020 - Resumo
O registro da atividade neural das células cerebrais de pacientes com doença de Parkinson desafia suposições antigas sobre como essa doença se manifesta no nível celular.
Acredita-se que um grupo de estruturas no interior do cérebro seja responsável pela progressão da doença de Parkinson. Essas estruturas, conhecidas como gânglios basais, desempenham um papel importante na coordenação do movimento por meio de duas vias motoras opostas: a "via indireta" que suprime o movimento e a "via direta" que promove o movimento. Foi relatado que a superativação da via indireta e a subativação da via direta levam a deficiências motoras associadas à doença de Parkinson (Albin et al., 1989; Bergman et al., 1990; Gerfen et al., 1990).
Estudos anteriores que investigaram os mecanismos celulares que causam essas anormalidades se concentraram amplamente nos neurônios de projeção espinhosos (SPNs - spiny projection neurons, para abreviar), um grupo de células encontradas em uma estrutura de gânglios basais conhecida como estriado. Essas células expressam um dos dois tipos de receptores de dopamina chamados D1 e D2. SPNs que expressam D1 são freqüentemente referidos como a origem da via direta, enquanto os SPNs que expressam D2 são referidos como a origem da via indireta. Essas vias, então, passam esse sinal entre várias estruturas dos gânglios da base até atingirem um grupo de células conhecido como núcleos de saída.
O corpo estriado recebe a maior parte de sua dopamina de uma área do cérebro que se degenera na doença de Parkinson. Acredita-se que essa perda de dopamina reduza a atividade de D1-SPNs e aumente a atividade de D2-SPNs, fazendo com que os neurônios no corpo estriado disparem em taxas diferentes: prevê-se que isso conduza a atividade excessiva da via indireta e reduza a atividade da via direta, que leva à atividade patológica em todos os gânglios da base (Gerfen e Surmeier, 2011; Figura 1A). Esta hipótese é conhecida como "modelo de taxa" e teve uma grande influência no campo da doença de Parkinson. No entanto, há evidências in vivo limitadas que mostram as taxas de disparo de SPNs mudando, particularmente de pacientes humanos.
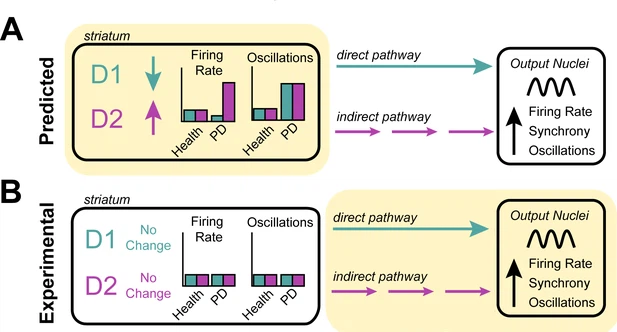
figura 1
Investigar a origem das características celulares associadas à doença de Parkinson. (A) Os neurônios no corpo estriado expressam os receptores D1 e D2 para o neurotransmissor dopamina. O modelo de taxa prevê que a perda de dopamina na doença de Parkinson diminui a atividade das células que expressam o receptor D1, aumenta a atividade das células que expressam o receptor D2 (esquerda) e aumenta a atividade oscilatória dos neurônios que expressam D1 e D2 (direita) . Acredita-se que essas mudanças na atividade alterem os sinais diretos (turquesa) e indiretos (roxo) que os neurônios D1 e D2 enviam para outras estruturas nos gânglios basais. Pensa-se que isso faz com que os neurônios a jusante nos núcleos de saída dos gânglios da base disparem mais rápido, mais sincronicamente e com mais oscilações - a fisiopatologia comumente encontrada em pacientes com doença de Parkinson. (B) Valsky et al. testou este modelo em pacientes humanos com doença de Parkinson e não conseguiu encontrar nenhuma evidência de neurônios no corpo estriado alterando suas taxas de disparo ou padrões de atividade. Isso sugere que as características neurológicas associadas à doença de Parkinson não se originam do estriado (conforme previsto pelo modelo de taxa), mas, em vez disso, podem se originar a jusante do estriado (destacado em amarelo), em outras estruturas dos gânglios basais.
Agora, na eLife, Marc Deffains (Universidade de Bordeaux) e colegas - incluindo Dan Valsky (Universidade Hebraica de Jerusalém) como primeiro autor - relatam experimentos investigando as taxas de disparo de SPNs em pacientes com doença de Parkinson (Valsky et al., 2020). A equipe conseguiu reunir dados de pacientes humanos submetidos a um procedimento cirúrgico que implanta eletrodos em regiões profundas do cérebro. Valsky et al. descobriram que as taxas de disparo de SPNs em pacientes com doença de Parkinson não eram diferentes dos valores esperados encontrados em primatas não humanos saudáveis. Uma análise computacional posterior, agrupando as diferentes taxas de disparo detectadas, foi incapaz de identificar duas populações distintas de neurônios que poderiam representar D2-SPNs hiperativos e D1-SPNs hipoativos.
Esses resultados foram em contraste com o único outro estudo humano que suporta as previsões feitas pelo modelo de taxa (Singh et al., 2016). No entanto, ambos os estudos usaram um método diferente para isolar e analisar a atividade dos neurônios. Valsky et al. aplicou critérios estritos para garantir que as taxas de tiro registradas viessem apenas de unidades individuais estacionárias e bem isoladas. Isso minimiza a chance de outros fatores, como ruído de movimento ou sinais de células danificadas, interferir nas taxas de disparo que estão sendo medidas. Valsky et al. mostraram que quando esses critérios não estavam em vigor, eles foram capazes de replicar as mudanças na atividade relatadas no estudo anterior, mas argumentaram que esta é uma conclusão espúria.
O fato de Valsky et al. não terem sido capazes de encontrar evidências para o modelo de taxa dentro do estriado não foi totalmente inesperado, uma vez que as exceções e limitações desse modelo têm se tornado cada vez mais documentadas (Obeso e Lanciego, 2011). Outros modelos propuseram que as anormalidades observadas nos gânglios da base surgem de neurônios que mudam seus padrões de atividade para disparar de forma mais irregular ou com oscilações aumentadas (Nelson e Kreitzer, 2014). Mas quando Valsky et al. pesquisaram seus dados para esses outros padrões de atividade, eles não puderam detectar qualquer uma dessas características nos neurônios estriados de pacientes com doença de Parkinson (Figura 1B).
Essas descobertas levantam muitas questões sobre o papel que o corpo estriado desempenha nas deficiências motoras associadas à doença de Parkinson. No entanto, duas variáveis críticas que não foram abordadas neste estudo são a sincronia (não oscilatória) e o recrutamento total de neurônios dentro do corpo estriado. Quando vários SPNs disparam simultaneamente, isso retransmite um sinal mais poderoso para áreas a jusante do cérebro do que se os SPNs fossem ativados independentemente. Portanto, se a depleção de dopamina permitisse que mais D2-SPNs fossem ativados simultaneamente, ou em maior número, isso poderia levar ao aumento da saída da via indireta do corpo estriado. No entanto, as técnicas usadas para registrar a atividade neuronal neste estudo significam que não é possível determinar se essa alteração ocorreu.
Essas descobertas destacam a necessidade de uma reavaliação crítica de suposições de longa data sobre os mecanismos celulares envolvidos no início da doença de Parkinson. Mesmo que este estudo não exclua completamente o estriado como fonte de anormalidades nos gânglios da base nessa condição, ele restringe os tipos de alterações que podem ser responsáveis. Ele também enfatiza os papéis das estruturas cerebrais que são tradicionalmente consideradas como "a jusante" do corpo estriado na geração de defeitos neuronais associados à doença de Parkinson (Figura 1B). Além disso, este trabalho fornece um conjunto de dados valioso e com curadoria rigorosa que será benéfico para o campo. Original em inglês, tradução Google, revisão Hugo. Fonte: Elifesciences.
Nenhum comentário:
Postar um comentário