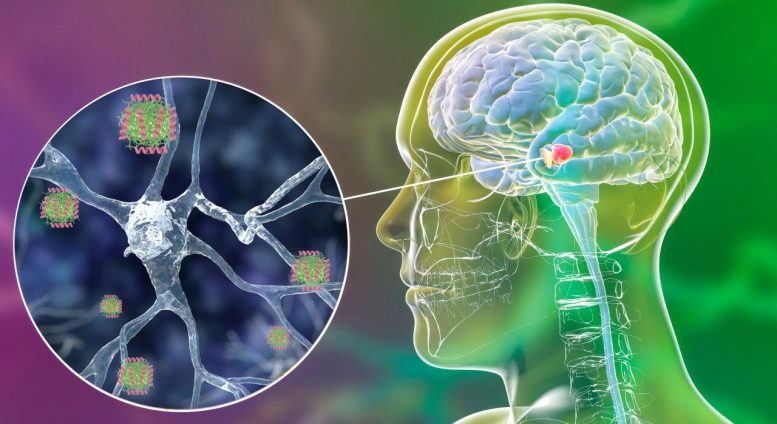
Representação esquemática do peptídeo humano LL37 ligando-se aos oligômeros tóxicos da α-sinucleína, bloqueando sua propagação e prevenindo sua neurotoxicidade. Crédito: Irantzu Pallarès, IBB-UAB
JULY 5, 2021 - Pesquisadores da UAB e da UniZar identificaram um peptídeo humano encontrado no cérebro que bloqueia os agregados de α-sinucleína envolvidos na doença de Parkinson e previne sua neurotoxicidade. O estudo, publicado na Nature Communications, sugere que este pode ser um dos mecanismos naturais do organismo para combater a agregação. A descoberta pode ajudar a desenvolver novas estratégias terapêuticas e de diagnóstico para a doença de Parkinson e outras patologias de sinucleína.
A morte de neurônios
especializados na síntese de dopamina, um dos principais
neurotransmissores do cérebro, deteriora as capacidades motoras e
cognitivas das pessoas com doença de Parkinson. A perda desses
neurônios está relacionada à agregação da alfa-sinucleína.
Estudos recentes mostram que os oligômeros, os agregados iniciais
dessa proteína, são as formas mais patogênicas da α-sinucleína e
são responsáveis pela disseminação da doença no
cérebro.
Portanto, uma das abordagens mais promissoras no
combate a esse distúrbio consiste em neutralizar esses oligômeros
e, assim, retardar a progressão patológica. No entanto, o fato de
esses agregados não apresentarem uma estrutura definida e serem
transitórios por natureza torna extremamente difícil identificar
moléculas que se liguem com força suficiente para explorar qualquer
aplicação clínica.
Uma colaboração científica entre
pesquisadores do Instituto de Biotecnologia e Biomedicina (IBB) da
Universitat Autònoma de Barcelona (UAB) e do Instituto de
Biocomputación y Física de Sistemas Complejos (BIFI) da Universidad
de Zaragoza (UniZar) pode agora identificar um peptídeo endógeno
humano que se liga forte e especificamente aos oligômeros de
α-sinucleína, evitando assim sua agregação e bloqueando sua
neurotoxicidade, dois processos intimamente relacionados ao declínio
neurodegenerativo da doença de Parkinson. A identificação e o
estudo do peptídeo, denominado LL-37, foi publicado recentemente na
Nature Communications.
“LL-37 interage com os oligômeros
tóxicos de alfa-sinucleína de maneira seletiva e com uma força
superior a de qualquer peptídeo anteriormente descrito, equivalente
à força exibida pelos anticorpos. Inibe a agregação em
concentrações muito baixas e protege as células neuronais de serem
danificadas”, destacam os pesquisadores.
Eles
acrescentam que “o LL-37 é encontrado naturalmente no organismo
humano, tanto no cérebro quanto no intestino, órgãos nos quais a
agregação de α-sinucleína ocorre na doença de Parkinson. Isso
significa que a atividade do LL-37 pode responder a um mecanismo
desenvolvido pelo próprio corpo como um meio de lutar naturalmente
contra esta doença. "
Estimulados por essa ideia, os
pesquisadores agora querem estudar como sua expressão pode ser
regulada e se essa estratégia pode se tornar uma terapia segura com
potencial de influenciar o curso da doença. “Existe a
possibilidade de que uma terapia para o Parkinson já esteja em nosso
interior e ela só precise ser ativada corretamente”, afirma
Salvador Ventura, pesquisador do IBB e coordenador do estudo.
A
identificação do LL-37 foi realizada no âmbito de uma pesquisa que
analisa a estrutura e as características de oligômeros patogênicos
com o objetivo de neutralizá-los de maneira específica. As análises
realizadas demonstram que peptídeos helicoidais com um lado
hidrofóbico e outro com carga positiva são ideais para esse tipo de
atividade. Os testes permitiram aos pesquisadores identificar três
moléculas com atividade antiagregante: além da molécula humana,
foram identificados um segundo peptídeo presente na bactéria e uma
terceira molécula artificialmente produzida.
Além de
representar uma possível rota terapêutica para a doença de
Parkinson e outras patologias de sinucleína, as moléculas
identificadas no estudo são ferramentas promissoras para o seu
diagnóstico, uma vez que discriminam entre espécies de α-sinucleína
funcionais e tóxicas.
“Até agora não havia moléculas
capazes de identificar seletivamente e eficientemente agregados
tóxicos de α-sinucleína; os peptídeos que apresentamos nessas
questões são únicos e, portanto, têm grande potencial como
ferramentas diagnósticas e prognósticas”, afirma o co-coordenador
do estudo Nunilo Cremades, pesquisador do BIFI-UniZar.
No
estudo, mais de 25.000 peptídeos humanos foram analisados
computacionalmente, e métodos de espectroscopia de molécula
única, bem como engenharia de proteínas, foram aplicados, além de
culturas de células in vitro usando oligômeros tóxicos.
Referência: “andaimes peptídicos α-helicoidais para atingir espécies tóxicas de α-sinucleína com afinidade nanomolar” por Jaime Santos, Pablo Gracia, Susanna Navarro, Samuel Peña-Díaz, Jordi Pujols, Nunilo Cremades, Irantzu Pallarès e Salvador Ventura, 18 de junho de 2021, Nature Communications. DOI: 10.1038 / s41467-021-24039-2. Original em inglês, tradução Google, revisão Hugo. Fonte: Sitechdaily.
Nenhum comentário:
Postar um comentário