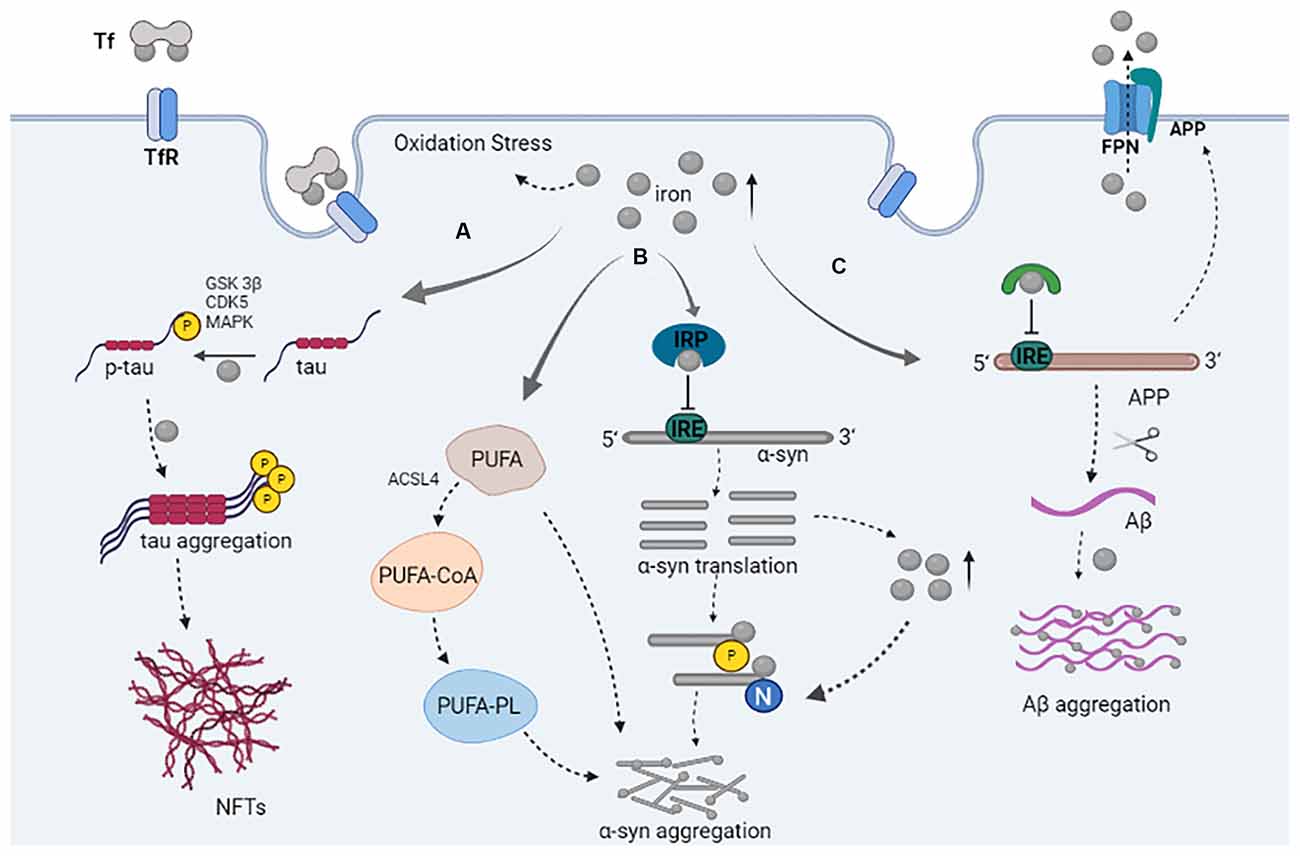
11 de outubro de 2021 - Demência da Doença de Parkinson: Efeitos Sinérgicos de Alfa-Sinucleína, Tau, Beta-Amilóide e Ferro.
Objetivo: atualização nos dispositivos de “Deep Brain Stimulation” aplicáveis ao parkinson. Abordamos critérios de elegibilidade (devo ou não devo fazer? qual a época adequada?) e inovações como DBS adaptativo (aDBS). Atenção: a partir de maio/20 fui impedido arbitrariamente de compartilhar postagens com o facebook. Com isto este presente blog substituirá o doencadeparkinson PONTO blogspot.com, abrangendo a doença de forma geral.
segunda-feira, 11 de outubro de 2021
Demência da Doença de Parkinson: Efeitos Sinérgicos de Alfa-Sinucleína, Tau, Beta-Amilóide e Ferro
Pesquisa busca desenvolver um novo tratamento para a doença de Parkinson
111021 - O projeto propõe o desenvolvimento de uma nanomedicação que impeça o avanço da doença, melhorando a qualidade de vida dos pacientes.
A doença de Parkinson é um distúrbio
progressivo e degenerativo do movimento neurológico que afeta
milhares de pessoas em todo o mundo. À medida que progride, a doença
torna-se cada vez mais incapacitante, dificultando ou
impossibilitando a realização de atividades cotidianas simples,
como tomar banho ou vestir-se. Muitos dos sintomas da doença de
Parkinson envolvem controle motor, a capacidade de controlar seus
músculos e movimentos. Essas alterações ocorrem principalmente
devido à morte de neurônios dopaminérgicos.
O custo
mundial dos medicamentos para essa doença é estimado em cerca de US
$ 11 bilhões, sendo o tratamento cerca de três a quatro vezes mais
caro para pacientes em estágios avançados da doença. Os
tratamentos existentes são sintomáticos, ou seja, substituem
parcialmente a dopamina em falta, mas não impedem a progressão da
doença. O projeto de pesquisa liderado pela cientista e neurologista
Katherine Athayde Teixeira de Carvalho e sua equipe, do Instituto dePesquisas Pelé Pequeno Príncipe, busca o desenvolvimento de um novo
tratamento, capaz de prevenir a morte de neurônios, preservando
assim a qualidade de vida dos portadores e reduzindo custos de
tratamento.
“As células-tronco têm capacidade
regenerativa e potencial de diferenciação. Evidências sugerem que
o efeito terapêutico dessas células advém de produtos
extracelulares, como microRNAs. Diante disso, nosso estudo propõe
uma terapia baseada em microRNAs. Os microRNAs que não apresentam
efeitos tóxicos são incorporados em nanoemulsões e usados em
testes pré-clínicos. A doença de Parkinson é induzida em
camundongos, e os animais são tratados por quatro a oito semanas com
a nanomedicação. Assim, espera-se o desenvolvimento de uma
nanomedicação segura para uma futura proposição de ensaio
clínico”, explica a pesquisadora. A nova terapia será testada por
via nasal e intravenosa.
“Teremos três anos para
desenvolver o projeto, ao final do qual esperamos contribuir para a
oferta de um tratamento mais resolutivo, mais econômico e com
resultados em mais qualidade de vida aos pacientes com doença de
Parkinson atendidos pelo Sistema Único de Saúde ( SUS)”, enfatiza
o cientista.
Financiamento
A pesquisa foi aprovada no
Programa Nacional de Genômica e Saúde de Precisão, lançado pelo
governo federal em 2020 para estimular o desenvolvimento científico
e tecnológico nas áreas de genômica e saúde de precisão no SUS,
além de impulsionar o crescimento da indústria nacional de
genômica. Para o seu desenvolvimento, recebeu um investimento de
mais de US $ 566 mil.
Centro de Processamento Celular
O
grupo de pesquisa liderado pela Dra. Katherine também está
trabalhando em um novo projeto, que pretende implantar um Centro de
Processamento Celular no Instituto de Pesquisa para o fornecimento de
células-tronco e seus derivados no âmbito da terapia celular
inovadora em todo o país.
“É um sonho que temos, mas
vai depender de muito apoio da sociedade para a concretização,
devido aos seus custos elevados”, destaca a diretora-geral do
Instituto, Ety Cristina Forte Carneiro.
Com a implantação
do Centro de Processamento Celular será possível isolar e cultivar
células-tronco de diversos tecidos, como adiposo e hematopoiético;
fornecer células-tronco para terapias halógenas e autólogas para o
tratamento padrão e já estabelecido para algumas doenças;
desenvolver terapias investigativas para doenças não tratadas,
também chamadas de doenças órfãs; e gerar receitas que sustentam
o próprio Centro, além de contribuir para a sustentabilidade
econômica do Complexo Pequeno Príncipe. Original em inglês,
tradução Google, revisão Hugo. Fonte: Pequenoprincipe.
Veja também: 09/10/2021 - Comunidade científica critica o corte milionário nas bolsas de estudo e apoio à pesquisa.
sábado, 9 de outubro de 2021
Uma nova visão da doença de Parkinson
Pesquisadores da Texas A&M AgriLife lançam luz sobre a neurotoxicidade no distúrbio
October 8,
2021 - Mais de 10 milhões de pessoas em todo o mundo têm a doença
de Parkinson, que é progressivamente debilitante e, atualmente,
incurável. Agora, os pesquisadores do Texas A&M AgriLife
descobriram uma nova maneira de estudar a progressão do distúrbio
em um nível molecular. A equipe também obteve novas pistas para um
tratamento.
Para continuar o trabalho no projeto, o
National Institutes of General Medical Sciences concedeu o
Outstanding Investigator Award e US $ 1,4 milhão em financiamento a
Dmitry Kurouski, Ph.D., professor assistente do Departamento de
Bioquímica do Texas A&M College of Agriculture and Life Sciences
Biofísica.
A doença de Parkinson causa vazamentos em
alguns neurônios
Em pacientes com Parkinson, uma proteína
normalmente benigna chamada alfa-sinucleína começa a se comportar
de maneira anormal - mas apenas em alguns neurônios. Um neurônio
saudável contém muitas cópias idênticas de alfa-sinucleína. Em
pacientes com Parkinson, essas cópias tendem a formar grandes
aglomerados ou agregados. Os neurônios que contêm esses agregados
ficam “vazando” e, eventualmente, morrem. Com o tempo, mais e
mais neurônios são afetados. Ainda assim, em outros neurônios no
mesmo cérebro, a alfa-sinucleína não se agrega na mesma extensão
e não causa problemas.
A alfa-sinucleína pode se
comportar de maneiras tão diferentes em neurônios diferentes por
causa do que mais está nas células. Por exemplo, a alfa-sinucleína
interage com os lipídios, uma classe de moléculas que são os
principais componentes das membranas celulares. Relacionado a isso,
vários grupos de pesquisa mostraram que a alfa-sinucleína pode
romper as membranas celulares e torná-las vazadas.
Aprender
mais sobre como os diferentes lipídios e a alfa-sinucleína
interagem pode responder por que a alfa-sinucleína é tóxica em
alguns neurônios, mas não em outros. No entanto, estudar esse
fenômeno tem sido um desafio. A alfa-sinucleína pode se agregar em
formas muito diferentes, como a água formando flocos de neve, bolas
de neve, pingentes de gelo ou icebergs. As formas variadas e mutáveis
dos agregados confundem várias técnicas que os pesquisadores
podem usar para estudá-los.
O que há de novo
Tianyi
Dou, estudante de graduação e co-autora, trabalhando no laboratório
(foto Texas A&M AgriLife de Dmitry Kurouski)
Um método
desenvolvido recentemente por Kurouski revelou-se bastante útil para
estudar a interação da alfa-sinucleína com os lipídios. Kurouski
e sua equipe estão usando duas técnicas sofisticadas que eles
usaram anteriormente em partículas de vírus de várias formas -
espectroscopia nano-Raman e espectroscopia nano-infravermelho.
Na
verdade, para o projeto de Parkinson, as técnicas já estão
fornecendo informações sobre as dobras, lipídios e aminoácidos na
superfície dos agregados de alfa-sinucleína e em seu núcleo.
“O
que descobrimos é que a estrutura e a toxicidade da alfa-sinucleína
podem ser alteradas exclusivamente por lipídios”, disse Kurouski.
Este trabalho foi publicado recentemente no Journal of Physical
Chemistry Letters.
Em seguida, a equipe investigará mais
como os componentes da membrana celular, como o colesterol, afetam a
toxicidade da alfa-sinucleína. Os pesquisadores planejam estudar
esses efeitos em células em cultura e em células de pacientes com
Parkinson.
No geral, a equipe visa determinar por que a
alfa-sinucleína tem efeitos tóxicos apenas em alguns neurônios. Os
pesquisadores levantam a hipótese de que a toxicidade dos agregados
de alfa-sinucleína é determinada por sua estrutura. Essa estrutura,
por sua vez, é controlada pela composição lipídica das membranas
neuronais.
“Com a idade e outros fatores, a composição
lipídica do cérebro muda”, disse Kurouski. “Se descobrirmos que
uma determinada composição lipídica promove a toxicidade da
alfa-sinucleína, poderíamos então encontrar um tratamento ou uma
dieta para mitigá-la?”
Tianyi Dou, uma estudante de
pós-graduação no laboratório de Kurouski, tem conduzido
experimentos de espectroscopia.
“Mesmo que o que estamos
fazendo possa não curar a doença diretamente, é essencial entender
o mecanismo pelo qual os agregados se tornam tóxicos”, disse Dou.
“É um projeto difícil e estamos dando o nosso melhor para
explorar as peças que faltam.”
Um projeto em construção
há anos
Kurouski estudou doenças relacionadas a agregados de
proteínas pela primeira vez como estudante de pós-graduação. Ele
sempre quis voltar a esse tópico em seu próprio laboratório, disse
ele.
“Quando comecei o laboratório, começamos a
trabalhar no Parkinson e levou vários anos para construir a
instrumentação para a análise estrutural que agora podemos fazer”,
disse Kurouski. “Testamos o método primeiro em vírus e vimos que
ele pode funcionar excepcionalmente bem para a caracterização de
pequenos objetos biológicos.”
Eventualmente, uma olhada
em outras doenças além do Parkinson
A equipe planeja usar o
mesmo método para estudar agregados de proteínas ligados às
doenças de Alzheimer, Huntington e príons.
“Esses
diferentes problemas podem mostrar sinergia ou abrir mais questões”,
disse Kurouski. “Queremos entender se o que estamos descrevendo é
um fenômeno geral.” Original em inglês, tradução Google,
revisão Hugo. Fonte: Bcbp.
Pesquisadores da Universidade de Utah identificam molécula que pode tratar, paralisar a doença de Parkinson
Oct. 8, 2021 - Daniel Scoles, professor associado de neurologia, e Stefan Pulst, cadeira de neurologia, discutem uma molécula recém-identificada que pode ajudar a tratar o Parkinson e retardar sua progressão. (University of Utah Health)
SALT LAKE CITY - Cientistas da University of Utah Health
fizeram uma descoberta que pode levar a uma nova maneira de tratar a
doença de Parkinson e, potencialmente, interromper sua
progressão.
Daniel Scoles, professor associado de
neurologia da universidade, e sua equipe de pesquisadores publicaram
recentemente um relatório sobre a descoberta no Journal of
Biological Chemistry, detalhando como a molécula desacelera a
produção de uma proteína chamada alfa-sinucleína pelas
células.
Em um cérebro saudável, acredita-se que a
alfa-sinucleína ajude as células nervosas a se comunicarem. No
entanto, em cérebros não saudáveis, esta proteína se agrega - ou
se aglomera - dentro dos neurônios para criar fibras pequenas e
delgadas chamadas fibrilas, que podem levar à morte de neurônios
produtores de dopamina e podem resultar em doenças
neurodegenerativas como a doença de Parkinson, corpo de Lewy
demência ou atrofia de múltiplos sistemas.
A dopamina é
um neurotransmissor, o que significa que atua como um mensageiro
entre as células nervosas e está envolvida na movimentação do
corpo, no aprendizado, na memória, no sono e na vigília e até na
regulação do humor. Quando os neurônios que produzem dopamina
morrem, as pessoas podem desenvolver a doença de Parkinson - um
distúrbio do sistema nervoso central que afeta o movimento e o
equilíbrio, às vezes causando tremores. Afeta mais de 10 milhões
de pessoas em todo o mundo e é degenerativa, por isso os sintomas
pioram à medida que a doença progride e mais neurônios morrem.
Os
tratamentos atuais para o Parkinson são medicamentos que agem
de forma semelhante à dopamina e podem ajudar a enviar essas
mensagens entre as células nervosas para controlar os sintomas, mas
não há cura para a doença ou qualquer maneira de interromper sua
progressão.
Embora a morte de neurônios na doença de
Parkinson ainda seja um mistério, os pesquisadores têm olhado para
a alfa-sinucleína como culpada, portanto, ser capaz de retardar a
produção da proteína potencialmente tóxica pode ajudar a retardar
a morte desses neurônios e, assim, retardar a degeneração
neural.
"A maioria dos casos de doença de Parkinson
são caracterizados por uma superabundância de alfa-sinucleína",
disse Scoles. "O pensamento predominante é que, se você
diminuir sua abundância geral, isso será terapêutico."
Duong
Huynh, um professor associado de pesquisa no departamento de
neurologia da Universidade de Utah, usou ferramentas de edição de
genes para inserir um gene de vaga-lumes que codifica uma proteína
produtora de luz em genes humanos. Quando a proteína era ativada,
ela fazia as células humanas brilharem sempre que o gene da
alfa-sinucleína estava ativo e escurecer quando ele estava menos
ativo.
Scoles e Huynh trabalharam com Stefan Pulst, o
presidente do departamento de neurologia da universidade, e
pesquisadores do National Center for Advancing Translation Sciences
para usar essas células produtoras de luz para executar milhões de
avaliações para ver como uma variedade de pequenas moléculas
funcionaria afetam o gene da alfa-sinucleína.
A equipe
usou uma configuração robótica para avaliar 155.885 compostos
diferentes nas instalações do centro.
Eles determinaram
que uma molécula chamada A-443654 provavelmente poderia inibir a
produção da proteína. Huynh morreu em 2018, e um pesquisador de
pós-doutorado chamado Mandi Gandelman fez mais testes e descobriu
que a molécula desacelerou o gene da alfa-sinucleína em células
humanas e também reduziu a produção do gene da proteína
alfa-sinucleína.
A molécula também pode aliviar o
estresse que os agregados de alfa-sinucelina colocam nas células, o
que pode fazer com que morram. Gandelman explicou que essa diminuição
do estresse na célula pode permitir que as células quebrem os
agregados que já se formaram.
“Podemos interromper a
produção, mas também precisamos degradar o que já está
agregado”, diz Gandelman. "Quanto mais agregado, mais tóxico
se torna."
A equipe está planejando conduzir
pesquisas adicionais para ver se a molécula pode ser desenvolvida em
um potencial tratamento para Parkinson e outras doenças
neurodegenerativas que envolvem agregados de proteína
alfa-sinuceleína. Eles também vão olhar para outras moléculas que
encontraram durante os testes que podem inibir a produção de
alfa-sinucleína.
Diferencial entre Lewy e Parkinson
As patologias em questão são demências primárias, mas você sabe explicar o diferencial entre Lewy e Parkinson?
Demência com Corpos de Lewy
A Demência com Corpos de Lewy (DCL) é um dos tipos mais comuns de demência, sendo a segunda forma mais comum depois da Doença de Alzheimer, afetando de 20 a 30% dos pacientes. Os sintomas costumam ser observados da sexta a nona década de vida, geralmente surgindo na metade da sétima década.
Para ter uma demência diagnosticada, o paciente precisa manifestar comprometimento em pelo menos duas das seguintes áreas cognitivas: memória, função executiva, linguagem, função visuoespecial e personalidade/comportamento. Espera-se então que haja o declínio significativo do nível funcional anterior. Esses acometimentos devem ser detectados o mais cedo possível em pacientes mais velhos para que possam ser investigadas causas secundárias.
Os Corpos de Lewy são inclusões intraneuronais encontradas na substância negra de pacientes com Doença de Parkinson (DP). Nos anos 70 foi proposta a denominação de um novo quadro demencial a partir da observação dessas inclusões em outras regiões do encéfalo, incluindo córtex cerebral. Essa nova etiologia teria como característica o quadro demencial associado à síndrome parkinsoniana e alucinações visuais.
Portanto, as principais características da DCL são:
Parkinsonismo
Flutuação do déficit cognitivo
Alucinações visuais (60 a 85% dos pacientes com DCL confirmada após necropsia)
A presença de uma dessas características sugere possível DCL, enquanto a presença de duas a três características sugere provável DCL. Existem também outros achados sugestivos como:
Distúrbio do Sono REM
Alta sensibilidade a antipsicóticos
Além de características adicionais como insuficiência autonômica, síncope e depressão. Esses achados são comuns a outros quadros demenciais, fazendo necessária a exclusão de outros fatores diagnósticos que justifiquem essas manifestações.
A DCL tem instalação insidiosa e progressiva, porém classicamente apresenta caráter flutuante prolongado, sendo essa flutuação observada no nível de alerta, funcionamento cognitivo e funcional.
Doença de Parkinson
O parkinsonismo é um dos mais frequentes tipos de distúrbio do movimento e apresenta-se com acinesia, rigidez, tremor e instabilidade postural, sendo necessários pelos menos dois desses componentes presentes para caracterização da síndrome.
A acinesia é caracterizada pela lentidão na execução dos movimentos, enquanto a rigidez se apresenta através da hipertonia plástica com resistência ao movimento do membro afetado. O tremor é tipicamente de repouso, unilateral ou assimétrico com redução à movimentação voluntária e desaparecimento durante o sono, com boa resposta ao uso de drogas antiparkinsonianas, como o levodopa. A instabilidade postural decorre da perda de reflexos de readaptação postural e pode gerar risco aumentado de queda.
A Doença de Parkinson é a causa de parkinsonismo primário e o seu diagnóstico requer identificação da síndrome parkinsoniana, boa anamnese, exame neurológico e resposta à terapia dopaminérgica, mas sobretudo, requer a exclusão de parkinsonismos secundários. Portanto, é importante saber diferenciar da DCL.
Como diferenciar?
A DCL pode ser categorizada como parte do Grupo A de Parkinsonismos Atípicos de diferenciação particularmente difícil com a DP. Possuem acometimento após meia-idade, além da apresentação esporádica. A instalação dos sintomas desse grupo costuma ser simétricas, associadas a outros distúrbios e de ruim resposta a antiparkinsonianos.
O parkinsonismo da DCL é primariamente manifestado por rigidez e bradicinesia, sendo o tremor um sintoma menos comum. Esses sintomas costumam ser simultâneos ou após o início da demência, ao contrário da DP em que a demência ocorre, normalmente, em estágio tardio. No entanto, o aparecimento de parkinsonismo após a demência não é uma manifestação específica da DCL e pode ser observada em pacientes com Doença de Alzheimer avançada. O momento de determinação da sequência entre demência e parkinsonismo pode ser dificultado pela apresentação clínica ambígua.
As alucinações visuais espontâneas raramente estão presentes na DP quando não associadas a drogas. Diferentemente da psicose verdadeira, muitos pacientes conseguem identificar as alucinações como tal, não sendo perturbados por elas. Além disso, a manifestação da síndrome extrapiramidal após uso de neurolépticos, mesmo em baixas doses, para controlar as alucinações visuais sugerem DCL. Apesar de um dos achados sugestivos da doença ser a alta sensibilidade a esses fármacos, a terapia não deve ser aplicada com objetivo diagnóstico.
Quanto a topografia, o diferencial entre Lewy e Parkinson é a localização basicamente cortical da DLC, enquanto o acometimento da DP é basicamente em gânglios da base.
O curso da DLC pode ser caracterizado por platôs ocasionais, mas eventualmente há progressão, que vai da demência grave à morte. Segundo o DSM-5, a duração média da sobrevida é de 5 a 7 anos e consequentemente, possui pior prognóstico. Fonte: Sanarmed.
INJEÇÕES DE TOXINA DE BOTULÍNICA (BOTOX) - PODEM AJUDAR OS SEUS SINTOMAS DA DOENÇA DE PARKINSON?
October 29, 2018 - USOS DA TOXINA DE BOTULÍNICA NA DOENÇA DE PARKINSON
Você provavelmente sabe que a toxina
botulínica (mais comumente referida como Botox®, entre outras
marcas) é usada para fins cosméticos para diminuir as rugas. Antes
de ser usada dessa forma, a toxina botulínica era usada para fins
médicos para controlar movimentos anormais. Nas mãos certas, pode
ser uma medida muito eficaz para controlar uma variedade de problemas
relacionados à DP.
O que é toxina botulínica?
A
toxina botulínica é uma substância produzida pela bactéria
Clostridium botulinum. O botulismo é causado pelos efeitos nocivos
dessa toxina. Se a toxina entrar na corrente sanguínea, ela pode se
espalhar por todo o corpo, causando fraqueza muscular generalizada.
Em sua forma mais desenvolvida, o botulismo pode causar dificuldade
em engolir e respirar, causando fraqueza dos músculos que controlam
essas funções.
A boa notícia é que, décadas atrás,
os cientistas aprenderam como isolar a toxina e aproveitar seu poder
para uso médico, e ela pode ser injetada com segurança em músculos
específicos para diminuir os movimentos indesejados desses
músculos.
Como funciona o Botox?
Normalmente, uma
mensagem é transmitida do nervo para o músculo pela liberação da
substância química acetilcolina das terminações nervosas. Quando
a toxina botulínica é injetada em um músculo, ela é absorvida
pelas terminações nervosas que fazem interface com o músculo e
interfere na liberação de acetilcolina, interrompendo assim a
comunicação entre o nervo e o músculo. Quando essa comunicação é
diminuída, o músculo fica enfraquecido e alguns sintomas de
Parkinson diminuem.
Condições tratadas com toxina
botulínica na doença de Parkinson
Distonia - A distonia se
refere a uma torção involuntária de uma parte do corpo, que pode
ser dolorosa e interferir no movimento desejado de uma pessoa. Na DP,
a distonia pode ser um sintoma motor devido à doença, aparecendo
logo pela manhã, antes de tomar a medicação ou quando uma dose da
medicação está passando. Como alternativa, a distonia pode ser um
efeito colateral da Levodopa. Uma distonia comum na DP de início
jovem envolve a curvatura do dedo do pé ou a inversão do pé (virar
para dentro). Essa distonia geralmente ocorre apenas em
circunstâncias particulares, como caminhada ou corrida. Outras
distonias envolvem o fechamento ocular frequente e persistente,
conhecido como blefaroespasmo, ou giro do pescoço, conhecido como
distonia cervical. Eles podem estar associados à DP, mas também
podem acompanhar outras formas de parkinsonismo, como atrofia de
múltiplos sistemas ou paralisia supranuclear progressiva. As
injeções de toxina botulínica, direcionadas a músculos
específicos que se movem excessivamente, podem ser eficazes em todos
esses cenários.
Tremor - Embora a toxina botulínica não seja comumente usada para essa finalidade, há relatos de casos na literatura mostrando seu uso eficaz para o controle do tremor.
Sialorréia - Provavelmente devido à diminuição da taxa de deglutição de pacientes com DP, sialorréia ou salivação pode ser uma característica da doença. Babar não é apenas um aborrecimento, mas pode resultar em constrangimento significativo e isolamento social. As injeções de toxina botulínica nas glândulas salivares podem diminuir a produção de saliva e, assim, diminuir a salivação.
Incontinência urinária - pode ser causada por uma bexiga pequena e contraída. As injeções de toxina botulínica na bexiga podem relaxar a bexiga, permitindo uma micção mais normal. Um efeito colateral conhecido desse tratamento, entretanto, é a infecção do trato urinário, portanto, certifique-se de estar ciente de todos os riscos e benefícios antes de iniciar o tratamento. Além disso, existem causas de problemas urinários na DP que não são passíveis de tratamento com toxina botulínica, portanto, você precisará discutir sua situação particular com um urologista.
A toxina botulínica é usada em vários outros
ambientes médicos, como distonia que não está relacionada à
doença de Parkinson, enxaqueca e espasticidade ou rigidez de membros
após acidente vascular cerebral.
Diferentes tipos de
toxina botulínica
Existem oito espécies diferentes de toxina
botulínica que ocorrem na natureza. No entanto, existem apenas dois
que são produzidos comercialmente - toxina botulínica A e B.
Os
produtos disponíveis comercialmente são:
Botox® -
toxina botulínica A
Dysport® - toxina botulínica A
Xeomin®
- Toxina botulínica A que é produzida livre de proteínas
complexantes
Myobloc® - toxina botulínica B
Cada um dos
agentes acima é aprovado pela FDA para uma lista ligeiramente
diferente de indicações clínicas.
COMO É O TRATAMENTO
COM TOXINA DE BOTULÍNICA PARA PARKINSON?
Os efeitos da toxina
botulínica ocorrem cerca de 3-10 dias após as injeções e duram
cerca de três a quatro meses, portanto, os tratamentos geralmente
precisam ser repetidos regularmente. Embora isso signifique injeções
de rotina, também significa que as injeções de toxina botulínica
não têm efeitos colaterais permanentes. Alguns efeitos colaterais
ainda podem ocorrer com as injeções de toxina botulínica e o
médico que realiza o procedimento irá analisá-los com você.
Uma vantagem de usar a toxina botulínica para o tratamento das condições observadas acima é que a toxina normalmente afeta apenas as áreas nas quais é injetada, ao contrário dos medicamentos orais que têm um efeito mais disseminado e, portanto, mais potencial para efeitos colaterais.
Efeitos colaterais do uso de Botox
Em
geral, os efeitos colaterais da toxina botulínica podem ser devido
ao enfraquecimento excessivo do músculo injetado, o que, se feito
nos músculos das pernas e pés, por exemplo, pode interferir na
caminhada.
Raramente, a toxina botulínica pode se
difundir para os músculos vizinhos e causar efeitos colaterais mais
generalizados. Por exemplo, as injeções nos músculos do pescoço
podem resultar na difusão local da toxina para os músculos usados
para engolir e causar dificuldade para engolir. Ainda menos
comuns são os efeitos colaterais devido à viagem da toxina para
partes mais distantes do corpo através da corrente sanguínea. Por
exemplo, as injeções de qualquer parte do corpo podem teoricamente
resultar em dificuldade para engolir ou respirar se a toxina chegar a
esses músculos. No entanto, isso é muito raro e as injeções de
toxina botulínica são geralmente muito seguras. O perfil de risco
completo para sua situação particular, entretanto, precisa ser
discutido com o médico que está aplicando as
injeções.
Normalmente, não há limitações após as
injeções e você pode retornar imediatamente às suas atividades
normais.
Embora os dermatologistas frequentemente usem a
toxina botulínica para fins cosméticos, apenas um neurologista está
qualificado para determinar se as injeções podem ajudar com certos
sintomas de DP. Se você estiver interessado em investigar se as
injeções de toxina botulínica podem ajudá-lo, discuta isso com
seu neurologista. Se ele sentir que podem ser úteis, mas não os
realiza, pode encaminhá-lo a um neurologista que o faça.
Dicas
e sugestões
As injeções de toxina botulínica podem ajudar no
manejo de certas características da doença de Parkinson.
Se
você acha que tem um sintoma que pode ser tratado com toxina
botulínica (distonia, salivação, incontinência urinária),
converse com seu neurologista.
Pode haver um papel para as
injeções de toxina botulínica no controle do tremor, mas isso é
menos comumente feito. Original em inglês, tradução Google,
revisão Hugo. Fonte: Apdaparkinson.
Leia mais sobre o tema AQUI.
sexta-feira, 8 de outubro de 2021
Pesquisa de estimulação cerebral profunda mostra resultados promissores para o tratamento da doença de Parkinson
A estimulação elétrica pulsada conduz a neuromodulação específica do tipo de célula. Crédito: Rachel Keady Keeney
OCTOBER 8, 2021 - Pesquisadores da Carnegie Mellon University descobriram uma maneira de tornar a estimulação cerebral profunda (DBS) mais precisa, resultando em efeitos terapêuticos que duram mais que o que está disponível atualmente. O trabalho, liderado por Aryn Gittis e colegas do Laboratório Gittis da CMU, avançará significativamente o estudo da doença de Parkinson.
O DBS permite que
pesquisadores e médicos usem eletrodos finos implantados no cérebro
para enviar sinais elétricos à parte do cérebro que controla o
movimento. É uma forma comprovada de ajudar a controlar os
movimentos indesejados do corpo, mas os pacientes devem receber
estimulação elétrica contínua para obter alívio dos sintomas. Se
o estimulador for desligado, os sintomas retornam
imediatamente.
Gittis, professor associado de ciências
biológicas do Mellon College of Science e docente do Instituto de
Neurociências, disse que a nova pesquisa pode mudar isso.
“Ao
encontrar uma maneira de intervir que tenha efeitos duradouros, nossa
esperança é reduzir muito o tempo de estimulação, minimizando os
efeitos colaterais e prolongando a vida útil da bateria dos
implantes.”
Gittis estabeleceu a base para esta
abordagem terapêutica em 2017, quando seu laboratório identificou
classes específicas de neurônios dentro do circuito motor do
cérebro que poderiam ser direcionados para fornecer alívio
duradouro dos sintomas motores em modelos de Parkinson. Nesse
trabalho, o laboratório usou a optogenética, técnica que usa a luz
para controlar neurônios geneticamente modificados. A optogenética,
entretanto, não pode ser usada atualmente em humanos.
Desde
então, ela vem tentando encontrar uma estratégia que seja mais
facilmente traduzida para pacientes que sofrem da doença de
Parkinson. Sua equipe obteve sucesso em ratos com um novo protocolo
DBS que usa rajadas curtas de estimulação elétrica.
“Este
é um grande avanço em relação a outros tratamentos existentes”,
disse Gittis. “Em outros protocolos de DBS, assim que você desliga
a estimulação, os sintomas voltam. Isso parece fornecer benefícios
mais duradouros - pelo menos quatro vezes mais do que o DBS
convencional.”
No novo protocolo, os pesquisadores têm
como alvo subpopulações neuronais específicas no globo pálido,
uma área do cérebro nos gânglios da base, com rajadas curtas de
estimulação elétrica. Gittis disse que os pesquisadores vêm
tentando há anos encontrar maneiras de fornecer estimulação de uma
maneira específica para o tipo de célula.
“Esse
conceito não é novo. Usamos uma abordagem "de baixo para cima"
para direcionar a especificidade do tipo de célula. Estudamos a
biologia dessas células e identificamos as entradas que as
impulsionam. Encontramos um ponto ideal que nos permitiu utilizar a
biologia subjacente”, disse ela.
Teresa Spix, a primeira
autora do artigo, disse que embora existam muitas teorias fortes, os
cientistas ainda não entendem completamente por que o DBS
funciona.
“Estamos meio que brincando com a caixa preta.
Ainda não entendemos cada peça do que está acontecendo lá, mas
nossa abordagem de curta duração parece fornecer maior alívio dos
sintomas. A mudança no padrão nos permite afetar diferencialmente
os tipos de células”, disse ela.
Spix, que defendeu seu
Ph.D. em julho, está animado com a conexão direta que essa pesquisa
tem com os estudos clínicos.
“Muitas vezes, aqueles de
nós que trabalham em laboratórios de pesquisa científica não têm
necessariamente muito contato com pacientes reais. Esta pesquisa
começou com questões de circuito muito básicas, mas levou a algo
que poderia ajudar os pacientes em um futuro próximo”, disse
Spix.
Em seguida, neurocirurgiões da Allegheny Health
Network (AHN) de Pittsburgh usarão a pesquisa de Gittis em um estudo
de segurança e tolerabilidade em humanos. Nestor Tomycz, um
cirurgião neurológico da AHN, disse que os pesquisadores começarão
em breve um estudo randomizado e duplo-cego de pacientes com doença
de Parkinson idiopática. Os pacientes serão acompanhados por 12
meses para avaliar as melhorias nos sintomas motores da doença de
Parkinson e na frequência de eventos adversos.
“Aryn
Gittis continua a fazer pesquisas espetaculares que estão elucidando
nossa compreensão da patologia dos gânglios da base nos distúrbios
do movimento. Estamos entusiasmados com o fato de sua pesquisa sobre
estimulação de explosão mostrar um potencial para melhorar o DBS,
que já é uma terapia bem estabelecida e eficaz para a doença de
Parkinson”, disse Tomycz.
Donald Whiting, o diretor
médico da AHN e um dos maiores especialistas do país no uso de DBS,
disse que o novo protocolo pode abrir portas para tratamentos
experimentais.
“Aryn está nos ajudando a destacar no
modelo animal coisas que vão mudar o futuro do que fazemos por
nossos pacientes. Na verdade, ela está ajudando a evoluir o
tratamento dos pacientes com Parkinson nas próximas décadas com sua
pesquisa”, disse Whiting.
Tomycz concordou. “Este
trabalho realmente ajudará a projetar a tecnologia futura que
estamos usando no cérebro e nos ajudará a obter melhores resultados
para esses pacientes”.
Referência: “A Neuromodulação Específica para a População Prolonga os Benefícios Terapêuticos da Estimulação Cerebral Profunda” 8 de outubro de 2021, Ciência.
DOI: 10.1126 /
science.abi7852
Outros co-autores do estudo são Shruti
Nanivadekar, Noelle Toong, Irene M. Kaplow, Brian R. Isett, Yazel
Goksen e Andreas R. Pfenning.
A pesquisa foi financiada
pela Richard King Mellon Foundation, o Lane Fellows Program, a
Michael J. Fox Foundation e o National Institutes of Health. Original
em inglês, tradução Google, revisão Hugo. Fonte: Scitechdaily. Veja também Aqui: 11 de Outubro de 2021 - Estudo usa técnica inovadora de eletroestimulação para tratamento de Parkinson.
quinta-feira, 7 de outubro de 2021
Transtorno do Sono Ligado à Neurodegeneração
Oct 7, 2021 - (HealthNewsDigest.com) - ROCHESTER, Minn. - Pessoas com distúrbio de comportamento do sono por movimento rápido dos olhos (REM) realizam seus sonhos. Enquanto dormem com segurança na cama, por exemplo, eles podem jogar os braços para cima para pegar uma bola imaginária ou tentar fugir de um agressor ilusório. Essas ações são mais do que apenas um incômodo. Pessoas com o transtorno têm 50% a 80% de chance de desenvolver uma doença neurodegenerativa séria dentro de uma década após o diagnóstico.
Uma equipe internacional
liderada por pesquisadores da Mayo Clinic, The Neuro (Montreal
Neurological Institute-Hospital) da McGill University e da Washington
University School of Medicine em St. Louis recebeu uma bolsa de cinco
anos com expectativa de um total de US $ 35,1 milhões para
desenvolver biomarcadores para a doença . Os biomarcadores, um
conjunto de descobertas em testes especializados, irão indicar:
A
bolsa - do Instituto Nacional de Envelhecimento (NIA) e do Instituto
Nacional de Doenças Neurológicas e Derrame (NINDS), ambos parte do
National Institutes of Health (NIH) - ajudará a estabelecer as bases
para ensaios clínicos focados em parar o incômodo condição de
progredir para uma doença debilitante.
"As chances
de pessoas com transtorno de comportamento do sono REM desenvolverem
uma doença neurodegenerativa são bastante alarmantes e, atualmente,
não há tratamentos para diminuir esse risco", disse Yo-El Ju,
MD, neurologista e co-diretor da Universidade de Washington em St.
Louis investigador. "Não temos como prever se e quando alguém
desenvolverá uma dessas doenças, ou qual vai contrair. E certamente
não sabemos como evitá-la."
O distúrbio de
comportamento do sono REM está ligado à doença de Parkinson, um
distúrbio do movimento; demência com corpos de Lewy, que causa
declínio cognitivo; e atrofia de múltiplos sistemas, na qual a
capacidade de regular funções involuntárias, como pressão
sanguínea, respiração e função da bexiga e intestino, se
deteriora.
Normalmente, as pessoas ficam paralisadas
durante o sono REM, a fase do sono em que ocorre o sonho. A encenação
de sonhos é um sinal precoce de que algo no cérebro não está
funcionando como deveria.
O distúrbio de comportamento do
sono REM está relacionado a doenças causadas pelo acúmulo de
aglomerados anormais da proteína alfa-sinucleína no cérebro. Esses
aglomerados geralmente se aglutinam no início do curso das doenças
em uma parte do cérebro que paralisa o corpo durante o sono REM.
Conforme essa área é danificada, as pessoas começam a se debater
enquanto sonham.
Vários medicamentos e imunoterapias
visando a alfa-sinucleína estão sendo desenvolvidos e podem estar
disponíveis para ensaios clínicos. Mas primeiro os cientistas
precisam identificar biomarcadores de doenças neurológicas
iminentes em pessoas com distúrbio de comportamento do sono
REM.
"As informações que prevêem o momento e o
tipo de distúrbio de sinucleinopatia estão quase certamente ocultas
em um ou mais dos biomarcadores que serão avaliados como parte deste
estudo", disse Bradley Boeve, MD, neurologista da Mayo Clinic e
co-investigador principal da bolsa . "Se pudermos identificar
biomarcadores que predizem o futuro, podemos nos concentrar nesses
biomarcadores para os próximos ensaios clínicos projetados para
atrasar o início ou prevenir a demência ou parkinsonismo."
O
Dr. Boeve, Professor da The Little Family Foundation de Lewy Body
Dementia na Mayo Clinic, e o Dr. Ju, o Professor de Neurologia
Barbara Burton e Reuben Morriss III da Washington University,
fundaram o Consórcio Norte-Americano de Sinucleinopatia Prodrômica
(NAPS) em 2018 para puxar Juntar pessoas com distúrbio
comportamental do sono de movimento rápido dos olhos e desenvolver
ferramentas padronizadas para estudá-las. Mais de 350 pessoas com
distúrbio comportamental do sono de movimentos oculares rápidos se
inscreveram no consórcio.
A nova concessão financia um
estudo maior para identificar biomarcadores nessas pessoas e novos
participantes. Este estudo maior, denominado NAPS2, é liderado pelos
drs. Ju e Boeve, bem como Ronald Postuma, M.D., neurologista do The
Neuro e do Instituto de Pesquisa do Centro de Saúde da Universidade
McGill e co-investigador principal.
Este estudo
acompanhará aproximadamente 430 participantes com distúrbio de
comportamento do sono REM e 60 pessoas sem problemas de sono por
cinco anos. Pacientes e participantes de controle serão submetidos a
exames clínicos abrangentes regulares e estudos do sono durante a
noite. Eles também fornecerão amostras de sangue e, se quiserem,
líquido cefalorraquidiano. Os participantes com distúrbio de
comportamento do sono REM serão submetidos a varreduras
cerebrais.
"NAPS2 é outro exemplo do apoio
coordenado e colaborativo que o NIH fornece para promover descobertas
e compreensão de distúrbios cerebrais devastadores", disse
Mack Mackiewicz, Ph.D., diretor do programa da Divisão de
Neurociência da NIA e cientista do projeto da NIA na bolsa. "Este
projeto, que considera o sono um fator de risco para demência, é
apenas um exemplo do amplo espectro de pesquisas que o NIH está
financiando sobre doenças neurodegenerativas." O NIA e o NINDS
estão financiando o NAPS2 igualmente com contribuições científicas
conjuntas e supervisão de projetos líderes da NIA.
Mais de 2 milhões de pessoas nos EUA e milhões em todo o mundo estão vivendo com distúrbios do corpo de Lewy, um grupo de doenças causadas por aglomerados de alfa-sinucleína em seus cérebros. Essas chamadas sinucleinopatias incluem demência com corpos de Lewy, doença de Parkinson e atrofia de múltiplos sistemas. Coletivamente, eles são o segundo tipo mais comum de doenças neurodegenerativas depois da doença de Alzheimer e compartilham várias semelhanças com a doença de Alzheimer.
Em ambos, aglomerados anormais de proteínas
se acumulam no cérebro por anos antes de qualquer sintoma: amilóide
e tau na doença de Alzheimer e sinucleína nos distúrbios do corpo
de Lewy. Cerca de metade das pessoas com aglomerados de amiloide e
tau relacionados à doença de Alzheimer também apresentam
aglomerados de sinucleína, razão pela qual as sinucleinopatias
estão incluídas entre as demências relacionadas à doença de
Alzheimer. Sintomas como mudanças no pensamento e no comportamento
ocorrem no início do processo da doença em ambas as condições.
Nem
todas as pessoas com distúrbios do corpo de Lewy têm problemas de
movimento durante o sono antes do início dos sintomas neurológicos.
Mas estudar pessoas com distúrbio de comportamento do sono REM nos
estágios iniciais de um processo neurodegenerativo pode fornecer
informações sobre como os aglomerados anormais de proteínas causam
danos ao cérebro, como surgem diferentes sintomas e como interromper
ou desacelerar a neurodegeneração.
"O objetivo mais
importante desta pesquisa é encontrar maneiras de identificar com
segurança a doença de Parkinson precoce, demência com corpos de
Lewy e atrofia de múltiplos sistemas", disse o Dr. Postuma.
"Quando fizermos isso, podemos começar a planejar ensaios para
prevenir a doença. Até agora, temos bons preditores clínicos da
doença, mas a pesquisa de biomarcadores ainda está se recuperando.
Os biomarcadores são importantes para ajudar a definir com precisão
em que estágio inicial as pessoas com Parkinson estão em, de modo
que terapias mais bem direcionadas possam ser fornecidas. "
Nove
centros clínicos estão participando do estudo:
Emory
University.
Massachusetts General Hospital / Harvard Medical
School.
Clínica Mayo.
Instituto de Pesquisa do Centro de
Saúde da Universidade McGill.
Stanford
Medicine.
UCLA.
Universidade de Minnesota.
Veterans
Affairs Portland / Oregon Health Sciences University.
Escola de
Medicina da Universidade de Washington em St. Louis.
Este estudo é apoiado pelo NIA e NINDS sob o número de prêmio U19AG071754. Este financiamento representa 100% dos custos totais do programa. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente a opinião oficial do NIH. Original em inglês, tradução Google, revisão Hugo. Fonte: Healthnewsdigest.
quarta-feira, 6 de outubro de 2021
Droga candidata a medicamento descoberta pelo Vanderbilt lab, para a doença de Parkinson, entra em ensaios clínicos
Oct. 6, 2021 - Vanderbilt-discovered drug candidate for Parkinson’s disease enters clinical trials