Pesquisador canadense estudará como as células imunológicas do cérebro são afetadas
25 de junho de 2025 - Uma bolsa de três anos da Parkinson Canada permitirá que um pesquisador canadense investigue os mecanismos pelos quais uma mutação recentemente descoberta no gene RAB32 está ligada à doença de Parkinson.
A bolsa de US$ 135.000 permitirá que Jay Penney, PhD, professor associado da Universidade da Ilha do Príncipe Eduardo, no Canadá, entenda como a mutação RAB32 afeta a função dos neurônios e da microglia, as células imunológicas residentes no cérebro, e aumenta o risco de Parkinson.
"A ideia é ver como a mutação afeta essas células e, ao entender isso, podemos começar a desvendar como ela contribui para a doença", disse Penney em uma reportagem da universidade. "Esta pesquisa pode nos ajudar a entender melhor como o Parkinson se desenvolve em nível celular e, então, potencialmente tratá-lo."
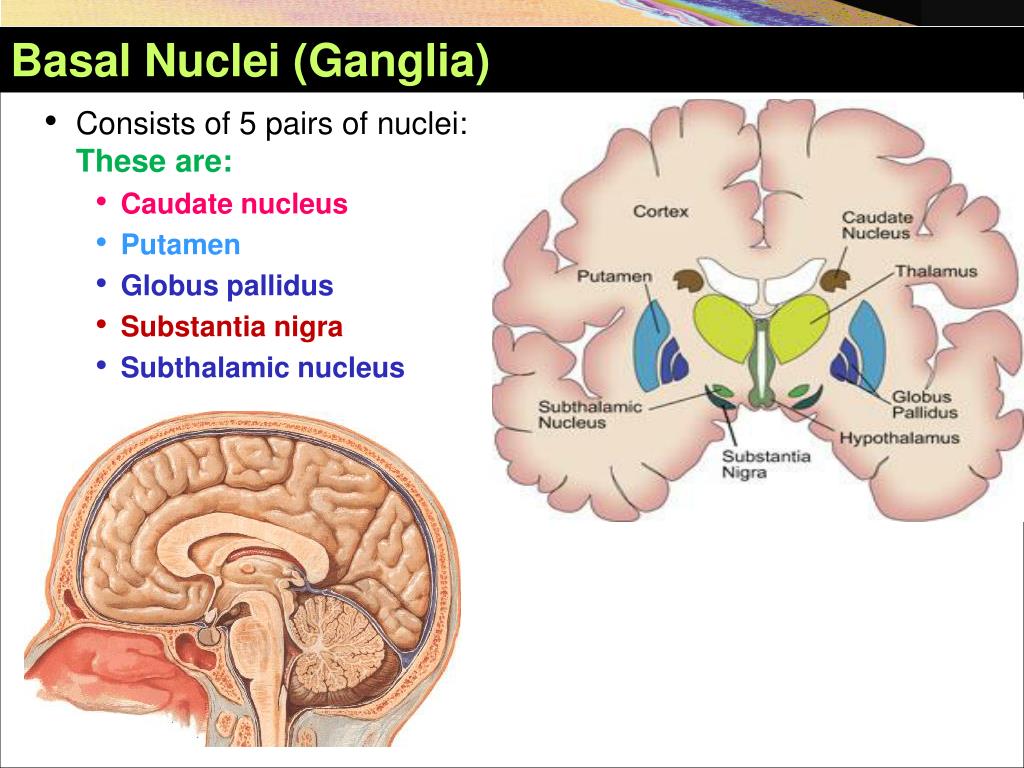
Mutação do gene RAB32 associada ao aumento do risco de Parkinson
A doença de Parkinson é causada pela perda progressiva de neurônios dopaminérgicos, as células nervosas responsáveis pela produção de dopamina, uma molécula sinalizadora envolvida no controle motor. Embora na maioria dos casos a doença de Parkinson seja esporádica, cerca de 15% dos pacientes são portadores de uma mutação genética que aumenta o risco de desenvolver a doença.
Uma das causas genéticas mais comuns são as mutações no gene LRRK2, que está ligado à ativação da enzima LRRK2. Mais recentemente, uma mutação no gene RAB32, chamada Ser71Arg, que também ativa o LRRK2, foi associada a um risco 13,2 vezes maior de Parkinson. Com base em um estudo global, a mutação Ser71Arg do RAB32 foi mais de 100 vezes mais prevalente em pessoas com Parkinson do que na população em geral.
O RAB32 é uma proteína que ajuda a mover materiais dentro das células e auxilia o sistema imunológico. É encontrada em altos níveis na microglia, onde ajuda a combater infecções, enviando substâncias que combatem micróbios para onde os micróbios nocivos estão escondidos.
Este é o primeiro passo para entender como as coisas estão acontecendo em nível celular. Se conseguirmos fazer isso, talvez no futuro possamos descobrir como encontrar uma cura.
No projeto, agora financiado, Penny usará modelos de células-tronco humanas para criar neurônios e microglia para entender como as mutações do gene RAB32 interrompem a função das células e levam ao Parkinson. As células-tronco têm a capacidade única de se desenvolver em diferentes tipos de células especializadas.
Embora modelos murinos sejam tradicionalmente usados para estudar a doença, as descobertas de estudos com camundongos muitas vezes não se traduzem diretamente em doenças humanas. "
Com modelos de células-tronco, podemos estudar células humanas diretamente. Isso é crucial para fazer descobertas que realmente se apliquem aos pacientes", disse Penney.
Embora o projeto esteja em seus estágios iniciais, Penney espera que ele possa contribuir para a identificação de alvos potenciais para o desenvolvimento de novos tratamentos para a doença de Parkinson.
“Este é o primeiro passo para entender como as coisas acontecem no nível celular. Se conseguirmos fazer isso, talvez no futuro possamos descobrir como encontrar uma cura”, disse ele. Fonte: parkinsonsnewstoday.