May 24, 2021 - FDA Approves IND for Ketamine in Parkinson Disease Dyskinesia.
Objetivo: atualização nos dispositivos de “Deep Brain Stimulation” aplicáveis ao parkinson. Abordamos critérios de elegibilidade (devo ou não devo fazer? qual a época adequada?) e inovações como DBS adaptativo (aDBS). Atenção: a partir de maio/20 fui impedido arbitrariamente de compartilhar postagens com o facebook. Com isto este presente blog substituirá o doencadeparkinson PONTO blogspot.com, abrangendo a doença de forma geral.
sexta-feira, 28 de maio de 2021
quinta-feira, 27 de maio de 2021
segunda-feira, 24 de maio de 2021
Previsão de parâmetros de estimulação cerebral profunda ideal para a doença de Parkinson usando ressonância magnética funcional e aprendizado de máquina
24 May 2021 - Resumo
Normalmente usado para a
doença de Parkinson (DP), a estimulação cerebral profunda (DBS)
produz benefícios clínicos marcantes quando otimizada. No entanto,
avaliar o grande número de configurações de estimulação
possíveis (ou seja, programação) requer várias visitas à
clínica. Aqui, examinamos se a ressonância magnética funcional
(fMRI) pode ser usada para prever as configurações de estimulação
ideais para pacientes individuais. Analisamos os dados de 3 T fMRI
adquiridos prospectivamente como parte de um estudo observacional em
67 pacientes com DP usando configurações de estimulação ideais e
não ideais. A estimulação clinicamente ideal produz um padrão de
resposta cerebral fMRI característico marcado pelo envolvimento
preferencial do circuito motor. Em seguida, construímos um modelo de
aprendizado de máquina prevendo o ideal em comparação com
configurações não ideais usando os padrões de fMRI de 39
pacientes com DP com DBS a priori clinicamente otimizado (88% de
precisão). O modelo prevê configurações de estimulação ideais
em conjuntos de dados invisíveis: pacientes com DP clinicamente
otimizados a priori e sem estimulação. Propomos que as respostas do
cérebro fMRI à estimulação DBS em pacientes com DP podem
representar um biomarcador objetivo da resposta clínica. Após
validação adicional com estudos adicionais, esses achados podem
abrir a porta para a programação de DBS assistida por imagem
funcional.
Introdução
A estimulação cerebral
profunda (DBS) tornou-se um padrão de terapia de tratamento para
distúrbios do movimento, particularmente doença de Parkinson (DP),
tremor essencial e distonia, e está sendo investigada em distúrbios
psiquiátricos e cognitivos, incluindo transtorno depressivo maior e
doença de Alzheimer1,2. DBS envolve a colocação de um eletrodo
para fornecer estimulação elétrica dentro de um circuito neural
disfuncional para suprimir a atividade aberrante e / ou conduzir uma
rede subativa. Apesar de seus benefícios reconhecidos, o mecanismo
terapêutico de ação do DBS permanece incompletamente
compreendido1.
O núcleo subtalâmico (STN), um hub
integral no circuito do motor, é o alvo mais comum no PD-DBS3. O
sucesso do DBS é criticamente dependente da aplicação da dose
apropriada de estimulação no melhor local da região-alvo. A
programação de DBS, o processo de titulação individual da dose de
estimulação elétrica fornecida para alcançar benefícios clínicos
máximos, permanece em grande parte um processo de tentativa e erro
baseado em observações clínicas imediatas e experiência
neurologista4,5. Algumas características clínicas respondem
rapidamente à estimulação elétrica no PD-DBS, por exemplo,
rigidez e, menos previsivelmente, tremor. Para outras deficiências,
incluindo bradicinesia, postura anormal e dificuldades de marcha,
onde pode haver benefícios lentos e progressivos, mas também
efeitos deletérios, a programação empírica representa um desafio
significativo4. Além da DP, a programação é particularmente
difícil em pacientes com DBS para indicações como distonia,
depressão e doença de Alzheimer, em que a resposta ao DBS
normalmente ocorre de forma retardada e pode até estar clinicamente
oculta por semanas a meses após o ajuste do parâmetro. Em cada
caso, a programação do DBS requer várias visitas clínicas
(normalmente a centros de saúde terciários) para testar o grande
número de parâmetros possíveis e descobrir o ambiente que produz o
maior alívio sintomático com o mínimo de efeitos colaterais4. Esse
processo impõe um desgaste significativo de tempo e financeiro aos
pacientes e aos sistemas de saúde6. Portanto, há uma necessidade de
um marcador fisiológico que possa predizer rápida e precisamente a
resposta clínica aos parâmetros DBS e melhorar a eficiência e
diminuir a carga das práticas de programação atuais4.
Os
avanços nas técnicas de neuroimagem aumentaram nossa compreensão
dos efeitos fisiológicos do DBS sobre a atividade dos circuitos
cerebrais (Tabela Suplementar 1). Uma vez que a ressonância
magnética em pacientes com DBS está sujeita a diretrizes de
segurança rígidas7, estudos têm aproveitado conectomas normativos
para investigar retrospectivamente regiões e redes cerebrais cuja
modulação está associada a benefícios clínicos8. A aquisição
de imagens de ressonância magnética funcional prospectiva (fMRI)
nesta população de pacientes tem sido amplamente limitada a estudos
usando hardware de ressonância magnética abaixo do ideal devido a
questões de segurança7. No entanto, avanços recentes estabeleceram
a segurança e a viabilidade do uso de várias sequências de
ressonância magnética em pacientes com DBS7,9 e permitiram um exame
mais detalhado das consequências fisiológicas da aplicação de DBS
em circuitos cerebrais específicos. A fMRI está sendo estudada
agora para investigar as consequências da estimulação nas redes
cerebrais10,11,12,13, mas ainda não foi usada para prever parâmetros
de estimulação DBS ideais nem para aumentar diretamente o potencial
terapêutico do DBS.
Neste trabalho, mostramos que dados prospectivos de fMRI podem identificar padrões de atividade cerebral associados a benefícios clínicos em pacientes com DP, servindo como um biomarcador da eficácia do DBS. Usamos fMRI para (1) identificar um padrão reprodutível do cérebro. Neste trabalho, mostramos que dados prospectivos de fMRI podem identificar padrões de atividade cerebral associados a benefícios clínicos em pacientes com DP, servindo como um biomarcador da eficácia DBS. Usamos fMRI para (1) identificar um padrão reproduzível de resposta do cérebro para estimulação DBS ideal e (2) prever configurações de DBS ideais com base nesses padrões de resposta do cérebro com um algoritmo de aprendizado de máquina (ML). Este algoritmo foi treinado em pacientes com DP já otimizados e testado em dois novos conjuntos de dados: um grupo de pacientes com DP otimizado para estimulação definida clinicamente a priori e um grupo de pacientes com DP sem estimulação.
Resultados
Com base em
publicações anteriores que descrevem a segurança e a viabilidade
da ressonância magnética em pacientes com DBS7,9,14,3 T dados de
fMRI foram adquiridos prospectivamente ao longo de 203 sessões de
fMRI (n = 67 pacientes com PD-DBS, Fig. 1, Tabela 1 ) Uma vez que STN
é o alvo mais comum para DBS no tratamento de DP, recrutamos
principalmente pacientes STN-DBS (n = 62). Também incluímos
pacientes com DBS de globo pálido interno (GPi) (n = 5), que é um
segundo local de estimulação comumente usado, para avaliar se
diferentes alvos de PD-DBS também poderiam contribuir para o modelo
de ML (Tabela 1). Cada sessão teve 6,5 min de duração e empregou
um paradigma de ciclagem DBS-ON / OFF de 30 s repetido seis vezes em
que a estimulação DBS unilateral esquerda foi administrada em
contatos ou tensões específicos do paciente, clinicamente definidos
ideais e não ótimos (Fig. 1C) . Conforme relatado anteriormente15,
isso foi feito para diferenciar entre as alterações do sinal BOLD
unilateral e contralateral, bem como para tentar imitar a programação
do DBS, o que geralmente envolve a avaliação de um eletrodo de cada
vez. Os dados de fMRI adquiridos foram pré-processados usando
um pipeline estabelecido que executou movimento e correção de tempo
de corte (Fig. 2). O sinal dependente do nível de oxigênio no
sangue (BOLD) foi extraído de 16 regiões de interesse motoras e não
motoras (ROIs) determinadas a priori com base na literatura existente
de PET e SPECT16,17,18,19 e nossa experiência com efeitos adversos
(por exemplo, problemas de fala e distúrbios visuais) com
configurações não ideais durante DBS fMRI20. Dado que estudos de
fMRI foram realizados de forma incomum devido a questões de
segurança, PET e SPECT informaram amplamente nossas escolhas de
ROIs. Os valores t absolutos (alterações BOLD) foram normalizados
por valores t médios positivos em áreas presumivelmente envolvidas
em estimulação não ideal. Isso foi feito para comparar os valores
t de DBS-ON de resposta BOLD vs. DBS-OFF de cada ROI entre os
pacientes e para levar em conta os efeitos adversos - uma
consideração importante, dado que o objetivo da programação do
DBS é maximizar os benefícios do motor enquanto minimiza os efeitos
adversos. Alterações BOLD normalizadas (recursos) de 39 pacientes
clinicamente otimizados a priori (n = 35 STN-DBS e n = 4 GPi-DBS) e
sua marcação binária associada (ideal vs. não ideal) foram usados
como entrada para treinar o modelo de ML (Fig. 2, Tabela 1).
Configurações de DBS clinicamente ideais foram obtidas usando
algoritmos publicados4,5. Posteriormente, dois conjuntos de dados
fMRI invisíveis (n = 9 para cada conjunto de dados) - adquiridos com
diferentes contatos ativos ou tensões - foram alimentados no modelo
de ML treinado para fins de validação. A capacidade do modelo para
determinar se uma configuração de DBS era ideal ou não ideal de
acordo com o padrão de fMRI correspondente foi avaliada (Fig. 2).
(segue…) Original em inglês, tradução Google, revisão Hugo.
Fonte: Nature.
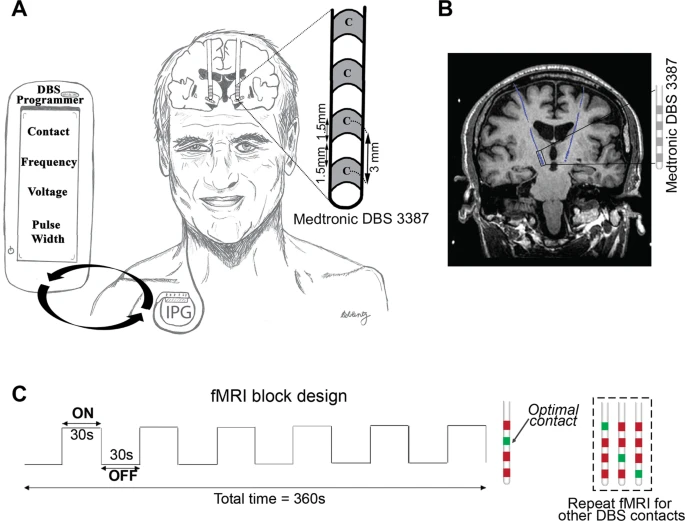
Um paciente DBS implantado com eletrodos DBS ativos e totalmente internalizados bilaterais direcionados ao STN. O cabo DBS (Medtronic 3387) tem quatro contatos (largura = 1,5 mm) espaçados 1,5 mm. Usando o programador DBS portátil, a programação DBS envolve a titulação da corrente fornecida ajustando vários parâmetros (isto é, contato do eletrodo, tensão, frequência e largura de pulso) a fim de fornecer o melhor alívio dos sintomas. B Imagem coronal ponderada em T1 demonstrando um paciente com DP com eletrodos DBS totalmente internalizados e ativos (azul) implantados no STN. Paradigma de projeto de bloco C fMRI usado durante a aquisição de dados 3 T fMRI. Enquanto o paciente estava deitado no scanner, a estimulação DBS unilateral (esquerda) foi ligada e desligada a cada 30 s por seis ciclos. O ciclo ON / OFF do DBS foi sincronizado manualmente para a aquisição de fMRI. Cada sequência de fMRI foi adquirida em contatos ou tensões ideais (verde) ou não ideais (vermelho). Neste exemplo, os quatro contatos foram selecionados com fMRI; o contato clinicamente ideal a priori (marcado em verde) e os contatos não ideais (marcado em vermelho) são mostrados. Estimulação cerebral profunda DBS, ressonância magnética funcional fMRI, doença de Parkinson.
Ciclistas da “Equipe Shaky” se preparam para a campanha da Universidade de Parkinson
24 May 2021 - Alguns dos mais proeminentes ativistas e apoiadores da Doença de Parkinson da Escócia devem pedalar centenas de milhares de milhas para uma campanha de arrecadação de fundos da Universidade de Dundee.
Os membros da "Equipe Shaky"
estarão montando em suas bicicletas para pedalar 30 quilômetros a
cada três dias ao longo de junho para o Desafio 30 Dias da
Universidade, arrecadando fundos para a pesquisa sobre Parkinson na
Universidade.
Três dos membros da equipe - Marc van
Grieken, Brendan Hawdon e Janet Kerr - foram diagnosticados com a
condição entre 2005 e 2019 e estão entre os ciclistas que farão
os 330 km mínimos (200 milhas) em uma combinação de bicicletas de
treinamento interno estático, e- mountain bikes e na estrada
aberta.
Marc diz que espera que seu compromisso espelhe o
dos pesquisadores da Universidade que trabalham para encontrar novas
terapias e tratamentos para a doença.
Ele disse: “Desde
o meu diagnóstico, conheci a equipe da Unidade de Fosforilação e
Ubiquitilação de Proteínas do Centro de Pesquisa Médica da
Universidade (MRC-PPU) e sempre fiquei impressionado com seu
compromisso em pesquisar esta doença.
“O compromisso, a
determinação e a motivação da equipe de pesquisa e sua crença de
que a ciência ajudará a deter, ou até mesmo a curar o Parkinson,
são extremamente encorajadores e é por isso que quero fazer minha
parte na arrecadação de fundos para apoiar seu trabalho.
"O
Parkinson é uma doença implacável que progride continuamente, mas
não somos uma minoria silenciosa, vamos nos fazer ouvir."
A
doença de Parkinson é uma doença neurodegenerativa incapacitante
que não tem cura e não tem como ser retardada. A droga de maior
sucesso no controle do Parkinson - a Levodopa - foi desenvolvida há
60 anos, mas desde então não houve nenhum grande avanço no manejo
ou tratamento da doença.
Todas as semanas, 30 pessoas na
Escócia são diagnosticadas com Parkinson, e é por isso que a
Universidade lançou o Desafio 30 Dias Realizado a partir de 1º de
junho, as pessoas são convidadas a fazer algo cansativo, inspirador,
relaxante, engraçado ou único em cada um dos 30 dias de junho, para
arrecadar pelo menos £ 120 para a Campanha de Pesquisa do Dundee
Parkinson.
A Universidade de Dundee é um centro líder de
pesquisa do Parkinson, hospedando especialistas de renome mundial que
se dedicam a melhorar nossa compreensão da condição. Seus esforços
são apoiados pela Campanha de Pesquisa de Dundee Parkinson, que foi
lançada em 2019 para estabelecer Dundee como o centro global de
pesquisa de Parkinson.
Desde 2017, a Equipe Shaky
continuou a arrecadar fundos, incluindo a corrida do Glasgow 10k em
2019, com seus 26 membros, incluindo o professor Dario Alessi e o Dr.
Esther Sammler, pesquisadores de Dundee Parkinson.
“Como
comunidade, as pessoas que vivem com Parkinson precisam falar mais
alto”, acrescentou Marc.
“Precisamos exigir mais
atenção. Campanhas como a da Universidade ajudam a esclarecer a
doença de Parkinson e o impacto que ela tem em tantas vidas.
“Os
pesquisadores de Dundee vivem para encontrar a cura. Acredito que com
o aumento e, acima de tudo, o esforço coletivo, pensando globalmente
e agindo localmente, temos a chance de resolver esta doença e
impedir que ela destrua vidas."
Para se inscrever no
Desafio 30 Dias para Parkinson, visite a página dedicada. Qualquer
pessoa que deseje saber mais sobre o Desafio, ou doar, pode fazê-lo
por meio da página JustGiving do evento. Original em inglês,
tradução Google, revisão Hugo. Fonte: Dundee.
Sargramostim em baixa dose mostra promessa em um pequeno teste inicial
MAY 24, 2021 - O tratamento com uma dose baixa do medicamento imunomodulador sargramostim foi bem tolerado e aliviou os sintomas motores em um pequeno ensaio clínico de pessoas com doença de Parkinson.
Os
resultados “fornecem a base para avaliações em maior escala para
determinar a eficácia clínica de um regime reduzido de sargramostim
na população [de Parkinson]”, de acordo com os
pesquisadores.
Com base nos resultados, a Partner
Therapeutics, que comercializa sargramostim sob a marca Leukine, está
planejando buscar aprovação regulatória para testes clínicos
adicionais de sargramostim para Parkinson.
As descobertas
foram publicadas no EBioMedicine do The Lancet, no estudo "Segurança,
tolerabilidade e perfil de biomarcador imunológico para o tratamento
com sargramostim de um ano da doença de Parkinson".
Um
dos processos biológicos que se acredita ser o causador da doença
de Parkinson é a inflamação anormal no cérebro. Como tal, os
tratamentos que reduzem a inflamação atípica têm atraído
interesse por seu potencial na doença de Parkinson.
Sargramostim
é uma versão feita em laboratório do fator estimulador de colônia
de granulócitos-macrófagos (GM-CSF). Essa proteína sinalizadora
ajuda a coordenar a atividade de várias células do sistema
imunológico; De particular relevância, GM-CSF é conhecido por
promover a atividade de células T reguladoras, ou Tregs, que podem
reduzir a inflamação.
Nos EUA, o sargramostim é
aprovado como um tratamento para certas condições em que é
benéfico ter diminuído a inflamação, incluindo algumas infecções
e certas situações relacionadas a transplantes de órgãos.
Em
um estudo anterior, os pacientes com Parkinson receberam uma alta
dose da terapia - 6 microgramas (ug) / kg / dia - e os resultados
indicaram que o tratamento melhorou a função motora. No entanto,
esta dosagem de tratamento também foi associada a eventos adversos,
incluindo reações no local da injeção, dor óssea e reações
inflamatórias.
Esses resultados levaram os pesquisadores
do Centro Médico da Universidade de Nebraska (UNMC) a realizar um
ensaio clínico (NCT03790670) para testar se uma dose mais baixa
poderia diminuir a extensão dos eventos adversos.
No
ensaio, cinco pessoas com Parkinson foram tratadas com sargramostim
em uma dose de 3 ug / kg / dia por cinco dias, seguido por um
"período de descanso" de dois dias. Este ciclo continuou
por um ano. Todos os participantes do ensaio eram homens caucasianos,
57-69 anos de idade, que haviam sido diagnosticados com Parkinson por
três a 15 anos.
Embora os resultados apresentados neste
estudo digam respeito apenas aos primeiros cinco pacientes e a um ano
de tratamento, o estudo foi estendido para dois anos e o tamanho do
estudo foi expandido para 10 pacientes após solicitações de
pacientes e investigadores.
Os participantes foram
submetidos a avaliações regulares dos sintomas relacionados ao
Parkinson, bem como avaliações de segurança.
Os
resultados mostraram que a dosagem reduzida de sargramostim foi
geralmente bem tolerada. Todos os participantes relataram pelo menos
alguns eventos adversos, sendo os mais comuns contagens elevadas de
células imunológicas, reações no local da injeção, quedas que
levaram a lesões e problemas digestivos como náuseas. Não houve
eventos adversos graves considerados relacionados ao tratamento.
Ao
comparar o perfil de segurança neste estudo com o anterior (onde os
participantes receberam 6 ug / kg / dia), os pesquisadores
descobriram que os participantes que receberam a dosagem mais baixa
experimentaram eventos adversos menos frequentes e menos graves.
Especificamente, os indivíduos que receberam a dosagem mais baixa
“experimentaram menos reações no local da injeção e erupções
cutâneas, menos dor no peito, parte superior do tronco, parte
inferior do tronco e extremidades e menos coceira, dor muscular e
fraqueza”, escreveram os pesquisadores.
Ao longo do
estudo, três dos cinco participantes experimentaram um abrandamento
dos sintomas motores, conforme avaliado pela Movement Disorder
Society - Unified Parkinson’s Disease Rating Scale Parte III. Os
escores de gravidade dos sintomas dos outros participantes não
mudaram substancialmente ao longo do tratamento.
As
análises estatísticas indicaram que contagens mais altas de células
Treg, como resultado do tratamento com sargramostim, foram associadas
a maiores benefícios relacionados aos sintomas motores do
tratamento. Esta descoberta “ajuda a apoiar a ideia de utilizar
Tregs como um alvo terapêutico”, escreveram os
pesquisadores.
Eles observaram que o estudo é limitado
por seu pequeno tamanho e população de pacientes homogênea, bem
como pela falta de um grupo de placebo.
"Pesquisas
adicionais são necessárias em um estudo clínico maior antes que
conclusões definitivas possam ser feitas sobre a eficácia do
medicamento", disse Howard Gendelman, MD, da UNMC e co-autor do
estudo, em um comunicado à imprensa.
A Partner
Therapeutics está planejando enviar um pedido de novo medicamento
experimental (IND) aos EUA. Food and Drug Administration para
sargramostim como um tratamento para Parkinson, solicitando permissão
regulatória para iniciar os testes clínicos do medicamento para
esta indicação.
"Nossa próxima etapa é enviar um IND para a doença de Parkinson e, em seguida, iniciar um estudo multicêntrico de Fase II, randomizado, duplo-cego e controlado por placebo para confirmar esses resultados em uma população maior de pacientes", disse John McManus, chefe de negócios oficial da Partner. Original em inglês, tradução Google, revisão Hugo. Fonte: Parkinsons News Today.
sexta-feira, 21 de maio de 2021
A hiposmia pode predizer o desenvolvimento de congelamento da marcha na doença de Parkinson
2021 May 20 - Hyposmia may predict development of freezing of gait in Parkinson's disease.
Mais sobre olfato, nos marcadores, ou AQUI.
Gerenciando os efeitos colaterais da doença de Parkinson
May 10, 2021 - O que é a doença de Parkinson?
A doença de Parkinson é uma doença
progressiva. Começa lentamente, geralmente com um pequeno tremor.
Mas, com o tempo, pode afetar tudo, desde a fala até a marcha e as
habilidades cognitivas.
Embora os tratamentos estejam cada
vez mais avançados, ainda não há cura para a doença de Parkinson.
Uma parte importante de um plano de tratamento de Parkinson
bem-sucedido é reconhecer e controlar os sintomas secundários -
aqueles que afetam a vida cotidiana.
Aqui estão alguns
dos sintomas secundários mais comuns e o que você pode fazer para
ajudar a tratá-los.
Parkinson e depressão
A
depressão entre pessoas com doença de Parkinson é bastante comum.
Na verdade, cerca de 50 por cento das pessoas com doença de
Parkinson sofrerão de depressão.
Enfrentar a realidade
de que seu corpo e sua vida nunca mais serão os mesmos pode afetar
sua saúde mental e emocional. Os sintomas de depressão incluem
sentimentos de tristeza, preocupação ou perda de interesse.
Fale
com um médico ou profissional de saúde mental licenciado se notar
sinais de depressão. A depressão geralmente pode ser tratada com
sucesso com medicamentos ou outras terapias.
Parkinson e
dificuldade para dormir
Mais de 75 por cento das pessoas com
doença de Parkinson relatam problemas de sono. Você pode ter um
sono agitado, onde acorda com frequência durante a noite.
Você
também pode ter ataques de sono ou episódios de início súbito do
sono durante o dia. Converse com seu médico sobre métodos de
tratamento, como tomar um remédio para dormir de venda livre ou
prescrito para ajudá-lo a regular seu sono.
Obstipação
e problemas digestivos
Conforme a doença de Parkinson progride,
seu trato digestivo fica mais lento e funciona com menos eficiência.
Essa falta de movimento pode levar ao aumento da irritabilidade
intestinal e constipação.
Além disso, certos
medicamentos frequentemente prescritos para a doença de Parkinson,
como anticolinérgicos, podem causar prisão de ventre. Comer uma
dieta balanceada com muitos vegetais, frutas e grãos inteiros é um
bom remédio inicial.
Produtos frescos e grãos inteiros
também contêm uma grande quantidade de fibras, o que pode ajudar a
prevenir a constipação. Suplementos de fibras e pós também são
uma opção para aqueles com Parkinson.
Certifique-se de
perguntar ao seu médico como adicionar gradualmente pó de fibra à
sua dieta. Isso irá garantir que você não tenha muito rapidamente
e piorará a constipação.
Parkinson e problemas
urinários
Assim como o trato digestivo pode ficar mais fraco,
os músculos do trato urinário também podem.
A doença
de Parkinson e os medicamentos prescritos para o tratamento podem
fazer com que seu sistema nervoso autônomo pare de funcionar
adequadamente. Quando isso acontece, você pode começar a sentir
incontinência urinária ou dificuldade para urinar.
Parkinson
e dificuldade para comer
Nos estágios mais avançados da
doença, os músculos da garganta e da boca podem funcionar com menos
eficiência. Isso pode dificultar a mastigação e a deglutição.
Também pode aumentar a probabilidade de babar ou engasgar ao
comer.
O medo de engasgar e outros problemas alimentares
podem afetar sua nutrição. No entanto, trabalhar com um terapeuta
ocupacional ou fonoaudiólogo pode ajudá-lo a recuperar algum
controle dos músculos faciais.
Parkinson e diminuição
da amplitude de movimento
O exercício é importante para todos,
mas é especialmente importante para pessoas com doença de
Parkinson. A fisioterapia ou exercícios podem ajudar a melhorar a
mobilidade, o tônus muscular e a amplitude de
movimento.
Aumentar e manter a força muscular pode ser
útil, pois o tônus muscular é perdido. Em alguns casos, a
força muscular pode atuar como um amortecedor, contrariando alguns
dos outros efeitos do Parkinson. Além disso, a massagem pode ajudar
a reduzir o estresse muscular e relaxar.
Aumento de quedas
e perda de equilíbrio
A doença de Parkinson pode alterar seu
senso de equilíbrio e fazer tarefas simples, como caminhar,
parecerem mais perigosas. Ao caminhar, mova-se lentamente para que
seu corpo possa se reequilibrar. Aqui estão algumas outras dicas
para evitar perder o equilíbrio:
Não tente virar girando
em seu pé. Em vez disso, vire-se caminhando em um padrão de
meia-volta.
Evite carregar coisas enquanto caminha. Suas mãos
ajudam o equilíbrio do corpo.
Prepare a sua casa e elimine
quaisquer riscos de queda, organizando os móveis com grandes espaços
entre cada peça. Os amplos espaços proporcionam um amplo espaço
para andar. Posicione os móveis e a iluminação de modo que não
sejam necessários cabos de extensão e instale corrimãos nos
corredores, entradas, escadarias e ao longo das paredes.
Parkinson
e problemas sexuais
Outro sintoma secundário comum da doença
de Parkinson é a diminuição da libido. Os médicos não têm
certeza do que causa isso, mas uma combinação de fatores físicos e
psicológicos pode contribuir para a queda do desejo sexual. No
entanto, o problema costuma ser tratável com medicamentos e
aconselhamento.
Parkinson e alucinações
Os
medicamentos prescritos para tratar a doença de Parkinson podem
causar visões incomuns, sonhos vívidos ou mesmo alucinações.
Se esses efeitos colaterais não melhorarem ou desaparecerem com a mudança na prescrição, seu médico pode prescrever um medicamento antipsicótico.
Parkinson e dor
A falta de movimento
normal associada à doença de Parkinson pode aumentar o risco de
músculos e articulações doloridos. Também pode causar dor
prolongada. O tratamento com medicamentos prescritos pode ajudar a
aliviar um pouco a dor. Os exercícios também ajudam a aliviar a
rigidez muscular e a dor.
Outros efeitos colaterais
Os
medicamentos prescritos para tratar a doença de Parkinson podem ter
efeitos colaterais adicionais. Esses incluem:
movimentos
involuntários (ou discinesia)
náusea (N.T.: causados por
excesso de levodopa)
hipersexualidade (N.T.: causado por
pramipexole)
jogo compulsivo ou comer demais
Muitos desses
efeitos colaterais podem ser resolvidos com a correção da dose ou
alteração da medicação.
No entanto, nem sempre é
possível eliminar os efeitos colaterais e ainda tratar a doença de
Parkinson de forma eficaz. Não pare de tomar ou faça auto-ajuste
dos medicamentos sem falar primeiro com o seu médico. (N.T.:
Recomendo auto-ajuste sob supervisão médica)
O
takeaway
Embora a doença de Parkinson tenha muitos efeitos
colaterais possíveis, ela pode ser controlada. Converse com seu
médico, cuidador ou grupo de apoio sobre como encontrar maneiras de
ajudá-lo a lidar com o Parkinson e viver com ele. Original em
inglês, tradução Google, revisão Hugo. Fonte: Healthline.