Sept. 1, 2021 - Is There a Connection Between Parkinson’s Disease and Pesticides?
Objetivo: atualização nos dispositivos de “Deep Brain Stimulation” aplicáveis ao parkinson. Abordamos critérios de elegibilidade (devo ou não devo fazer? qual a época adequada?) e inovações como DBS adaptativo (aDBS). Atenção: a partir de maio/20 fui impedido arbitrariamente de compartilhar postagens com o facebook. Com isto este presente blog substituirá o doencadeparkinson PONTO blogspot.com, abrangendo a doença de forma geral.
quinta-feira, 2 de setembro de 2021
Uma Visão Geral da Estimulação Cerebral Profunda (DBS) para Parkinson
September 01, 2021 - A estimulação cerebral profunda (DBS) é um tratamento cirúrgico comum para os sintomas da doença de Parkinson, como rigidez, movimentos lentos e tremores.
O DBS não cura a
doença, mas pode melhorar os sintomas que o medicamento para
Parkinson não está tratando adequadamente. Isso pode resultar em
mais tempo “on” (uma duração mais longa para se sentir bem)
durante o dia.
Este artigo irá discutir como a
estimulação cerebral profunda funciona para o Parkinson, os
sintomas que ela trata, benefícios e riscos, e o que esperar após
esta cirurgia.
Como funciona a estimulação cerebral profunda para o Parkinson?
A estimulação cerebral profunda funciona modificando a atividade elétrica anormal no cérebro. Foi aprovado pela primeira vez para tremores de Parkinson em 1997 e tornou-se um tratamento estabelecido para controlar sintomas motores (relacionados ao movimento) adicionais da doença de Parkinson.
DBS envolve três componentes principais:
Leads: Leads (eletrodos) são implantados no cérebro em uma região responsável pela atividade motora (muscular).
Gerador de pulso implantável (IPG): um procedimento separado é realizado para implantar um dispositivo operado por bateria (aproximadamente do tamanho de um cronômetro) no tórax (sob a clavícula) ou no abdômen. Um IPG é semelhante a um marca-passo para o coração e foi cunhado por alguns como um "marca-passo para o cérebro".
Extensão: Um fio fino e isolado é passado por baixo da pele entre os eletrodos e o gerador de pulsos implantável para fornecer a estimulação elétrica do gerador de pulsos aos eletrodos.
A área alvo no cérebro é primeiro identificada por imagem de ressonância magnética (MRI) ou tomografia computadorizada (TC). Em seguida, os eletrodos são colocados por meio de pequenos orifícios que um cirurgião faz no crânio.
Esta é considerada uma cirurgia minimamente invasiva que é realizada na sala de cirurgia com anestesia local. Geralmente requer pernoite.
O IPG é inserido em um procedimento cirúrgico separado na sala de cirurgia, cerca de uma semana depois.
Após algumas semanas, um neurologista começa a programar a unidade. Esse processo pode levar várias semanas a meses. Quando isso for concluído, as pessoas serão capazes de gerenciar (ligar e desligar) o dispositivo com um controle remoto portátil.
Não se sabe exatamente como o DBS funciona. Acredita-se que os impulsos do gerador interfiram ou bloqueiem sinais elétricos anormais (disparo defeituoso de células nervosas) no cérebro que estão associados à doença de Parkinson.
Acredita-se que esses sinais elétricos anormais, chamados de “ruído” por alguns neurologistas, resultem da perda de dopamina nas células cerebrais que controlam o movimento.1 A dopamina é uma substância química que transmite mensagens entre os nervos.
Existem três regiões diferentes no cérebro onde os eletrodos podem ser implantados: 1
Núcleo subtalâmico
Globus pallidus internus
Núcleo ventral intermediário do tálamo
O DBS do núcleo subtalâmico e do globo pálido pode ajudar com os sintomas motores da doença de Parkinson, enquanto o DBS do núcleo intermediário ventral é feito principalmente para controlar os tremores.
Os sintomas que o DBS trata
A estimulação cerebral profunda é usada principalmente para tratar os sintomas motores (relacionados aos músculos) da doença de Parkinson, mas isso pode variar um pouco entre os diferentes locais de colocação. Os sintomas tratados incluem: 2
Movimentos lentos (bradicinesia)
Tremores
Rigidez (rigidez)
Movimentos anormais (discinesias): discinesias são frequentemente um efeito colateral de medicamentos para a doença de Parkinson e incluem movimentos involuntários, como torcer, balançar a cabeça, contorcer-se e muito mais.
DBS geralmente não é útil com problemas de caminhada ou equilíbrio, embora melhorias nos sintomas acima possam afetar indiretamente a caminhada. Também não fornece benefícios significativos para os sintomas não motores da doença de Parkinson, como alterações cognitivas, alterações de humor (como depressão ou ansiedade) ou problemas de sono.1
Os benefícios do DBS podem ser estimados observando-se como uma pessoa responde à levodopa.3 Os sintomas que respondem à levodopa freqüentemente respondem ao DBS (geralmente no mesmo grau). Mas os sintomas que não mudam com a levodopa provavelmente não melhoram com o DBS.
O DBS geralmente permite uma redução na dosagem de levodopa, que por sua vez pode resultar em menos movimentos involuntários (discinesias) e uma redução no tempo “off”. O resultado muitas vezes é a melhoria da qualidade de vida.4
Quem pode se beneficiar com a estimulação cerebral profunda?
Vários critérios podem ajudar a identificar pessoas que são boas candidatas à estimulação cerebral profunda. Isso inclui pessoas que: 3
Vivem com a doença de Parkinson há pelo menos cinco anos, embora o procedimento tenha sido aprovado para os primeiros sintomas em 2016 e agora esteja sendo avaliado para ver se oferece benefícios para pessoas no início da doença.
Têm sintomas que
não são bem controlados com medicamentos
Estão respondendo
aos medicamentos para Parkinson (levodopa): o procedimento só deve
ser feito para pessoas que estão respondendo a este tratamento, mas
os efeitos dos medicamentos flutuam durante o dia e a eficácia do
medicamento está diminuindo.
Descobrir que os sintomas não
controlados estão diminuindo sua qualidade de vida
Estão
relativamente bem cognitivamente (sem demência significativa)
No
momento, não há limite de idade definido para DBS, mas a eficácia
pode ser menor em pessoas mais velhas.5
Quem deve ter
estimulação cerebral profunda?
Se os medicamentos estão
ajudando com seus sintomas relacionados ao movimento da doença de
Parkinson, mas não os controlam completamente, você pode ser um
candidato à estimulação cerebral profunda.
Locais de
estimulação cerebral profunda e controle de sintomas
Embora a
estimulação do núcleo subtalâmico (STN) e do globo pálido (GPi)
ajude a melhorar os sintomas motores da doença de Parkinson, os
estudos encontraram algumas diferenças.
O DBS do terceiro
alvo, o núcleo intermediário ventral, pode ser benéfico para
controlar os tremores, mas não funciona tão bem no tratamento de
outros sintomas motores da doença de Parkinson.
Em um
estudo canadense, a segmentação do núcleo subtalâmico permitiu
que as pessoas reduzissem as doses de seus medicamentos em um grau
maior, enquanto a segmentação do globo pálido interno foi mais
eficaz para movimentos anormais (discinesias).6
Em outro
estudo, a estimulação cerebral profunda STN também levou a uma
maior redução nas dosagens de medicamentos. No entanto, a
estimulação GPi resultou em maior melhora na qualidade de vida e
também pareceu ajudar na fluência da fala e nos sintomas de
depressão.7
Os efeitos colaterais do DBS às vezes podem
incluir mudanças cognitivas sutis (um declínio). Outro estudo
comparou esses efeitos em relação a essas diferentes áreas.
GPi
mostrou declínios neurocognitivos menores (olhando para coisas como
atenção e memória) do que STN, embora os efeitos fossem pequenos
com ambos. Em uma nota positiva, ambos os procedimentos pareceram
reduzir os sintomas de depressão após a cirurgia.
Riscos
e efeitos colaterais da estimulação cerebral profunda
Como
qualquer cirurgia, a estimulação cerebral profunda pode ter efeitos
colaterais e acarreta riscos potenciais. Também é importante
considerar as complicações e efeitos colaterais dos medicamentos
que você toma, uma vez que suas dosagens muitas vezes podem ser
reduzidas após a cirurgia.
Embora o DBS possa causar
efeitos colaterais, também pode reduzir os efeitos colaterais dos
medicamentos.
Riscos
Os riscos da estimulação
cerebral profunda podem ser divididos em aqueles que envolvem a
cirurgia e aqueles que envolvem os dispositivos e conexões. É
importante observar que o DBS não parece causar nenhum dano
permanente significativo ao cérebro.
Além dos riscos
gerais de cirurgia e anestesia, as complicações podem
incluir:
Sangramento (hemorragia
cerebral)
Golpe
Infecção
Colocação imprecisa dos
cabos ou falta de benefício, mesmo com a colocação
adequada
Convulsões
Confusão
Dor ou inchaço no
local onde os eletrodos são implantados ou onde a bateria é
colocada
Os problemas de hardware podem incluir mau
funcionamento, erosão, migração ou fratura dos cabos ou falha da
bateria.
Em uma revisão de mais de mil pessoas que se
submeteram a DBS para distúrbios do movimento, complicações foram
incomuns.9 Embora cerca de 4% experimentaram sangramento
assintomático nos ventrículos ou córtex do cérebro, apenas 1%
apresentou sintomas de hemorragia cerebral. Outros 0,4% sofreram um
acidente vascular cerebral.
Complicações de longo prazo
relacionadas ao hardware foram observadas em menos de 2% das pessoas
e não exigiram cirurgia adicional. Também foi observado que as
complicações mais comuns poderiam ser evitadas, pelo menos em algum
grau, com planejamento e técnica cuidadosos.9
Efeitos
colaterais
Os efeitos colaterais são comuns, mas tendem a ser
relativamente leves. Eles também podem ser divididos em aqueles
relacionados à cirurgia e aqueles relacionados à estimulação.
É
digno de nota que, ao contrário de outros procedimentos cirúrgicos
para a doença de Parkinson, quaisquer efeitos colaterais que ocorram
com a estimulação podem ser revertidos simplesmente desligando o
dispositivo.
Os efeitos colaterais relacionados à
cirurgia podem incluir dor de cabeça ou piora dos sintomas
emocionais.
Os efeitos colaterais relacionados à
estimulação ocorrem em quase todas as pessoas enquanto o
dispositivo está sendo programado e esse processo pode levar várias
semanas. Isso pode incluir:
Sensações de dormência ou
formigamento (parestesias)
Contrações musculares
involuntárias, rigidez, congelamento (sensação de que seus pés
estão grudados no chão) ou a sensação de músculos sendo
puxados
Distúrbios de fala ou linguagem
Visão dupla ou
outros problemas visuais
Movimentos indesejados
(discinesias)
Tontura
Perda de equilíbrio
Mudanças
de humor (depressão, raiva, ansiedade)
Piora da marcha ou
equilíbrio com caminhada 2
O que esperar depois do DBS
A cirurgia para
implantar os eletrodos geralmente requer pernoite, enquanto o IPG é
geralmente implantado como cirurgia no mesmo dia. Durante a
recuperação, seu cirurgião conversará com você sobre os cuidados
com suas feridas, quando você pode tomar banho e quaisquer
restrições de atividades. Normalmente, é recomendado que qualquer
levantamento de peso seja evitado por algumas semanas.
Depois
de mais duas a quatro semanas, você voltará para ter seu
dispositivo programado. Esse processo continuará por várias semanas
para garantir que as configurações de estimulação sejam ideais
para controlar seus sintomas. Durante essas visitas, a você será
mostrado como ligar e desligar o dispositivo com o dispositivo
portátil e verificar o nível da bateria.
Assim que a
programação for concluída, você terá visitas regulares de
acompanhamento para verificar e ajustar a estimulação para manter o
máximo benefício para seus sintomas.
Viver com um
dispositivo DBS
As baterias costumam durar de três a cinco
anos, mas isso pode variar. As baterias recarregáveis podem durar
até 15 anos.
Existem várias precauções relacionadas a
dispositivos elétricos / magnéticos que são importantes, mas
geralmente fáceis de acomodar. Itens como telefones celulares,
computadores e eletrodomésticos geralmente não interferem no
estimulador. Mantenha o seu cartão de identificação do estimulador
à mão quando estiver fora de casa, na carteira ou na
bolsa.
Detectores de roubo
Esteja ciente de que
alguns dispositivos podem fazer com que o transmissor seja ligado ou
desligado. Isso inclui monitores de segurança (detectores de roubo)
que podem ser encontrados na biblioteca e em lojas de varejo.
Se
isso ocorrer acidentalmente, geralmente não é grave, mas pode ser
desconfortável ou resultar na piora dos seus sintomas se o
estimulador for desligado. Ao visitar lojas com esses dispositivos,
você pode pedir para ignorar o dispositivo apresentando seu cartão
de identificação do estimulador.
Eletrônicos
Domésticos
Mantenha o ímã (N.T.: não mais utilizado)
usado para ativar e desativar o estimulador a pelo menos 30
centímetros de distância de televisores, discos de computador e
cartões de crédito, pois o ímã pode danificar esses
itens.
Viagem aérea / detectores de metal
Fale
com o pessoal da checagem quando viajar de avião, pois o metal no
estimulador pode disparar o detector. Se você for solicitado a
passar por uma triagem adicional com uma varinha de detector, é
importante falar com a pessoa que está fazendo a triagem sobre o seu
estimulador.
Como o estimulador contém ímãs, segurar um
dispositivo portátil de detecção sobre o estimulador por mais de
alguns segundos pode interferir no monitoramento do dispositivo.
Outras técnicas, como uma revista, são uma opção. Novamente, é
importante ter seu cartão de identificação do estimulador com você
quando voar.
Diagnóstico Médico e Tratamento
Certos
tipos de ressonância magnética podem ser feitos com o dispositivo,
mas você sempre deve verificar com seu médico a compatibilidade do
seu dispositivo. Alternativas, como tomografia computadorizada,
geralmente são recomendadas caso você não possa fazer ressonância
magnética. O uso de terapia térmica para músculos doloridos, seja
durante a fisioterapia ou com almofada térmica, deve ser
evitado.
Durante a cirurgia, o uso de cautério (queima de
pequenos vasos sanguíneos sangrando) deve ser evitado, por isso é
importante que seus médicos estejam cientes de que você tem um
estimulador no local. Os tratamentos adicionais que podem interferir
com o dispositivo incluem ultrassom terapêutico, litotripsia (para
cálculos renais) e radioterapia.
Preocupações
eletromagnéticas ocupacionais
Devem ser evitadas
situações que impliquem a exposição a grandes campos magnéticos,
máquinas de radar ou correntes de alta tensão. Isso pode incluir
estar perto de geradores de energia elétrica, subestações
elétricas, antenas de rádio amador, soldadores de arco, torres de
transmissão e torres de comunicação de microondas.
A
maioria dessas exposições potenciais são ocupacionais, por isso é
importante conversar com seu médico sobre seu ambiente de trabalho
antes de retornar ao trabalho.
Resumo
A estimulação
cerebral profunda é um procedimento no qual dispositivos
implantáveis transmitem impulsos elétricos ao cérebro. Pode
ser usada para aliviar os sintomas motores da doença de Parkinson em
alguns pacientes. Tem alguns riscos e pode haver efeitos colaterais
leves. Muitas vezes, permite que a pessoa use menos levodopa e tenha
uma melhor qualidade de vida.
Uma palavra de Verywell
A
estimulação cerebral profunda pode resultar no controle a longo
prazo da rigidez, tremores e movimentos lentos em pessoas com doença
de Parkinson que atendem aos critérios de tratamento. Infelizmente,
o DBS não afeta a história natural (progressão) da doença, nem
controla os sintomas não motores, como alterações cognitivas ou
problemas de humor.
Pelo menos até que tenhamos melhores
tratamentos que abordem o processo subjacente da doença de
Parkinson, em vez de tratar apenas os sintomas, o DBS oferece uma
opção adicional para ajudar as pessoas a lidar com os sintomas
muito frustrantes da doença. Original em inglês, tradução Google,
revisão Hugo. Fonte: Very Well Health.
PERGUNTAS FREQUENTES
Por quanto tempo a estimulação cerebral profunda trata os sintomas da doença de Parkinson?
A estimulação cerebral profunda pode muitas vezes fornecer um benefício de longo prazo para a doença de Parkinson. Um estudo de 2021 demonstrou que a estimulação cerebral profunda STN permanece benéfica por pelo menos 15 anos.11 Um estudo de 2020 mostrou que a estimulação cerebral profunda GPi foi benéfica por pelo menos cinco anos.12
Dito isso, é importante observar que o DBS trata os sintomas e não o processo da doença subjacente. Uma vez que a doença de Parkinson é uma doença progressiva sem cura no momento, a piora geralmente é esperada ao longo do tempo, apesar do tratamento ideal.
quinta-feira, 26 de agosto de 2021
quarta-feira, 25 de agosto de 2021
O ácido úrico pode ajudar a proteger os neurônios, aliviar os sintomas não motores
August 25, 2021 - Entre as pessoas com doença de Parkinson, aqueles com baixos níveis de ácido úrico no sangue - um antioxidante natural - tendem a ter sintomas não motores mais graves, como ansiedade, depressão e disfunção cognitiva, indica um estudo.
Ele também mostrou uma ligação entre os níveis
de ácido úrico e o volume de matéria cinzenta no cérebro.
Este
trabalho "é o primeiro relatório examinando as relações
entre soro UA [ácido úrico] e manifestações clínicas e
características de imagem em pacientes com DP [doença de
Parkinson]", de acordo com seus pesquisadores.
O
estudo “Os baixos níveis de ácido úrico sérico estão
associados aos sintomas não motores e ao volume de massa cinzenta do
cérebro na doença de Parkinson”, foi publicado na Neurological
Sciences.
O ácido úrico é um produto residual produzido
quando o corpo quebra certas moléculas, mas ainda tem uma função:
a saber, o ácido úrico é um antioxidante importante no corpo. Os
antioxidantes, como o nome sugere, são substâncias que podem
reduzir o estresse oxidativo - um tipo de dano celular que se
acredita estar envolvido no desenvolvimento e progressão de muitas
doenças, incluindo o Parkinson.
Pesquisadores na China
analisaram os níveis de ácido úrico no soro (sangue) em 88 pessoas
com Parkinson e 68 controles com idades semelhantes e sem a doença.
Entre os pacientes com Parkinson, 56 estavam em um estágio
relativamente inicial da doença, enquanto os 32 restantes tinham a
doença em estágio intermediário a tardio.
“Estudos
têm mostrado que os níveis de UA estão significativamente
relacionados à gravidade do comprometimento dopaminérgico no
[cérebro]. Portanto, formulamos a hipótese de que os níveis
séricos de UA diminuem gradualmente à medida que a DP progride”,
escreveram os pesquisadores.
As análises estatísticas
mostraram que, em média, os níveis de ácido úrico foram
significativamente mais baixos naqueles com Parkinson do que naqueles
sem a doença.
Mais especificamente, os níveis de ácido
úrico foram significativamente mais baixos em indivíduos com
Parkinson inicial em relação a controles saudáveis. Seus níveis
em pacientes com doença mais avançada, por sua vez, eram
significativamente mais baixos do que seus níveis nos primeiros
pacientes com Parkinson.
Os pesquisadores também
procuraram correlações entre os níveis de ácido úrico e vários
sintomas e sinais de Parkinson, avaliados com questionários
padronizados e testes médicos apropriados.
Os resultados
indicaram que os baixos níveis de ácido úrico foram
estatisticamente associados a uma maior gravidade de vários sintomas
de Parkinson, incluindo depressão, ansiedade, disfunção cognitiva,
apatia e disfagia (dificuldade para engolir).
“Essas
descobertas indicam que o monitoramento dos níveis séricos de UA
pode ser um biomarcador potencial ou uma estratégia de tratamento
para DP”, escreveram os pesquisadores.
Além disso, uma
correlação significativa foi evidente entre os níveis de ácido
úrico e massa cinzenta do cérebro entre os pacientes de Parkinson:
indivíduos com baixos níveis de ácido úrico tendiam a ter menos
massa cinzenta e vice-versa. A massa cinzenta é a parte do cérebro
que abriga os corpos dos neurônios (células nervosas); o outro tipo
de tecido cerebral - a matéria branca - abriga as projeções que os
neurônios usam para se conectar uns aos outros.
Com base
nesses resultados, “especulamos que o UA, como substância
protetora na DP, tem um amplo efeito protetor nos neurônios do
cérebro”, escreveram os pesquisadores.
Uma limitação
notável dessa análise é que os pesquisadores estavam testando
correlações - isto é, associações estatisticamente
significativas. Por definição, esse tipo de análise não pode
identificar relações de causa e efeito: é plausível que níveis
reduzidos de ácido úrico levem ao agravamento dos sintomas, mas
também é possível que o dano neurológico que causa o agravamento
dos sintomas de Parkinson também reduza os níveis de ácido
úrico.
“Para esclarecer o significado clínico da
concentração sérica de UA em pacientes com DP, estudos clínicos e
pré-clínicos maiores são necessários para explorar ainda mais o
mecanismo potencial subjacente às mudanças nos níveis séricos de
UA em DP”, concluiu a equipe. Original em inglês, tradução
Google, revisão Hugo. Fonte: Parkinsons News Today.
Infelizmente isto não é novidade desde 2012. Veja matérias afins AQUI e AQUI.
terça-feira, 24 de agosto de 2021
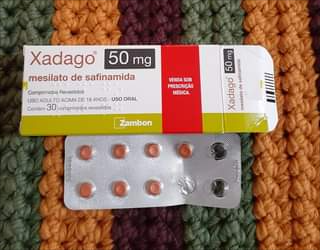
XADAGO: um relato (por Koka Keiber).
Direção e Parkinson
May 21, 2018 - Dirigir ou não dirigir? Os membros do MyParkinsonsTeam lutam com essa questão regularmente. Como tremores, fadiga e outros sintomas dificultam o manuseio seguro do carro, a família e os amigos costumam pedir aos membros que parem de dirigir. “Minha esposa e filhos me imploraram para desistir de minhas chaves no outono passado, por medo de eu CAUSAR um acidente tanto quanto entrar em um”, explicou um membro. “Eu evito a rodovia e não dirijo à noite', escreveu outro. Perder a independência de dirigir é o maior medo de muitos membros. “Estou relutante em desistir de dirigir porque quero me agarrar ao último pedaço de independência que tenho!” um membro compartilhou. Outros membros do MyParkinsonsTeam encontraram maneiras de se adaptar: “Aluguei uma scooter com mobilidade que uso como meio de transporte”. Conectar-se com outras pessoas afetadas pelo Parkinson pode ser útil ao tomar decisões sobre como dirigir.
No
MyParkinsonsTeam, a rede social e grupo de apoio online para aqueles
que vivem com Parkinson, os membros falam sobre uma série de
experiências pessoais e lutas. Dirigir é um dos 10 principais
tópicos mais discutidos.
Aqui estão alguns tópicos de
perguntas e respostas sobre como dirigir (questões com links na fonte):
• Alguém mais
experimentou restrições de direção?
• A sonolência
significa que você não deve dirigir?
• Gostaria de
saber quantas pessoas ainda se sentem confortáveis ao dirigir.
Para vocês que não dirigem mais, qual foi o fator decisivo?
Aqui
estão algumas conversas sobre como dirigir:
• Posso controlar o tremor na mão direita, mas dirigir o provoca. Embora amudança de posição no volante pare o tremor.
• Fui diagnosticado em 2011. Ainda estou dirigindo, mas tento minimizar por causa dos meus nervos.
• Estou começando a notar efeitos colaterais do tratamento. Posso ter ataques de ansiedade ao dirigir.
Original em inglês, tradução Google, revisão Hugo. Fonte: MyParkinsonsTeam.
sábado, 21 de agosto de 2021
Pesquisa indica potencial de substância extraída da peçonha de vespas para evitar progressão da doença
20/08/2021 - A Doença de Parkinson (DP) é uma doença degenerativa do sistema nervoso central, crônica e progressiva. A doença é causada pela degeneração das células da chamada substância negra, uma região do cérebro cujas células produzem a dopamina, substância responsável pela condução das correntes nervosas para o corpo. A redução ou a ausência de dopamina afeta os movimentos e causa os sintomas. O quadro afeta os movimentos, causando tremores, lentidão, rigidez muscular, alterações na fala e na escrita.
No Brasil, são pouco mais de 200 mil pessoas convivendo com o problema, de acordo com dados da Organização Mundial da Saúde (OMS). Foi pensando em pacientes com essa realidade, que procuram atendimento no Sistema Único de Saúde (SUS), que a pesquisadora Márcia Renata Mortari, da Universidade de Brasília (UnB), desenvolveu uma pesquisa para aprimorar métodos de diagnóstico e avaliar a segurança de novos medicamentos para o controle da doença.
Com fomento da Fundação de Apoio à Pesquisa e Inovação do Distrito Federal (FAPDF), ela coordenou o estudo “Doença De Parkinson Em Foco: aprimoramento de escalas de avaliação cognitiva de pacientes e segurança farmacológica de novos compostos neuroprotetores”.
De acordo com a estudiosa, uma grande limitação para o estudo da progressão da doença, assim como de seu estágio em pacientes atendidos pelo SUS, é causada, em parte, pelo uso de escalas com baixa especificidade, sensibilidade e acurácia que dificultam uma intervenção farmacêutica adequada e uma correta orientação aos familiares, compatíveis com as necessidades dos pacientes. Outra lacuna apontada por ela é a ausência de remédios disponíveis capazes de reduzir ou impedir a evolução da doença.
“Em especial, o diagnóstico precoce dos quadros demenciais pelo rastreio cognitivo é de fundamental importância, pois permite que o apoio ao paciente seja iniciado precocemente, além de possibilitar que o paciente participe das decisões sobre o planejamento futuro de sua vida. Quanto aos medicamentos, até o momento, fármacos utilizados para impedir a progressão da doença com ação neuroprotetora são pouco estudados e não utilizados no tratamento”, afirma Márcia Mortari.
Por isso, os principais objetivos da pesquisadora foram traduzir, adaptar e aprimorar escalas internacionais de avaliação de sintomas não motores (especialmente cognitivos) para aplicabilidade na avaliação e diagnóstico de pacientes no SUS. Outra vertente do estudo avaliou a segurança de novas fórmulas produzidas com o peptídeo neuroprotetor Neurovespina, composto desenhado a partir do protótipo identificado na peçonha de vespas sociais.
Vespas sociais (Foto: divulgação)
Adaptação de escalas para diagnóstico
Duas escalas foram avaliadas e adaptadas pelos pesquisadores: Escala de Avaliação Cognitiva da Doença de Parkinson (PD-CRS) e Cambridge Neuropsychological Test Automated Battery (CANTAB).
Para avaliação da PD-CRS, foram considerados 640 indivíduos saudáveis (40 anos ou mais) de cinco regiões brasileiras distintas. A escala foi adaptada para o Português e validada através de comparação com testes neuropsicológicos amplamente utilizados: Teste das Trilhas, teste dos Trigrama-consonante, Teste dos Cinco Pontos, Fluência verbal (frutas e animais).
“PD-CRS é uma escala com alta capacidade de triar, discriminar e diagnosticar de forma precoce graus leves de perda cognitiva em pacientes com doença de Parkinson, diferentemente de outras escalas neurocognitivas utilizadas na prática clínica atual”, destaca a coordenadora da pesquisa.
De acordo com os resultados atingidos, a escala demonstrou adequada reprodutibilidade e fidedignidade, podendo ser considerada válida como método diagnóstico. A PD-CRS mostrou-se uma escala com alta capacidade de triar, discriminar e diagnosticar, de forma precoce, graus leves de perda cognitiva em pacientes com doença de Parkinson, diferentemente de outras escalas neurocognitivas utilizadas na prática clínica atual.
Já a CANTAB é uma plataforma digital de mensuração de funções cognitivas com ampla aceitabilidade internacional no meio de pesquisa em neurociência cognitiva e no diagnóstico neuropsicológico. No estudo, ela foi aplicada em 30 participantes voluntários subdivididos em DP-CN (Doença de Parkinson – Cognição Normal) e DP-CCL (Doença de Parkinson – Comprometimento Cognitivo Leve). A escala demonstrou adequada validade do teste cognitivo.
Potencial medicamento
Além da adaptação das escalas para diagnóstico, a pesquisadora também testou a segurança de fórmulas produzidas a partir do peptídeo neuroprotetor Neurovespina, presente na peçonha de vespas sociais.
“Os peptídeos bioativos têm sido excelentes candidatos ao desenvolvimento de novos medicamentos, devido a algumas características da sua atividade biológica, como alta especificidade, potência, baixa toxicidade e diversidades química e biológica. A otimização de peptídeos tem sido muito empregada com o intuito de minimizar problemas inerentes aos peptídeos e viabilizar o uso dessas moléculas como fármacos”, indica Márcia Mortari.
Os resultados do projeto indicaram que a forma injetável da Neurovespina, em doses de 7 e 4mg/KG, foi capaz de reduzir a descoordenação motora e mostrou ação neuroprotetora de neurônios produtores de dopamina na substância negra do cérebro (substantia nigra).
“Este estudo tem revelado que a Neurovespsina é um fármaco promissor capaz de prevenir a progressão da doença e perda neuronal. Além disso, foram realizadas a produção de duas novas formulações, para a administração intranasal”, afirma Márcia Mortari.
A cientista destaca, ainda, que a Neurovespina teve todo o seu perfil de segurança farmacológica avaliado em roedores e primatas, tendo sido bem tolerada sem geração de feitos adversos. Ela ressalta as vantagens do uso da substância, como alta potência, excelente seletividade, baixa toxicidade química e imunogenicidade.
Quanto à importância e aplicabilidade da pesquisa para o SUS, Mortari explica que a disponibilidade de um fármaco neuroprotetor é inexistente até o momento e que “os resultados poderão revolucionar a terapia de desordens neurodegenerativas, proporcionando uma melhora significativa para os pacientes e diminuindo os custos diretos e indiretos no SUS”.
A pesquisa foi fomentada pela FAPDF “Chamada FAPDF/MS-DECIT/CNPQ/SESDF 01/2016 – Programa de Pesquisa para o SUS: Gestão Compartilhada em Saúde”, cujo objetivo foi apoiar a execução de projetos de pesquisa científica, tecnológica e de inovação que promovam a formação e a melhoria da qualidade da atenção à saúde no Distrito Federal, no contexto do Sistema Único de Saúde (SUS).
Confira a apresentação final de resultados da pesquisa aqui (link "fora do ar"). Fonte: Confap. Veja também aqui: 11/8/21 - Fármaco se revela promissor na luta contra o Parkinson.
Afinal, não se trata de algo novo. Há 3 anos, 10 de fevereiro de 2018, postamos esta notícia AQUI.
:max_bytes(150000):strip_icc():format(webp)/GettyImages-1094966418-09191962922845bd86e4fc9114ff8080.jpg)