130223 - Evidências têm se acumulado nos últimos anos para uma relação bidirecional entre o cérebro e o intestino que desempenha um papel importante na doença de Parkinson (DP). Pesquisas recentes sugerem que o microbioma intestinal desempenha um papel fundamental nessa relação e que o eixo microbioma-intestino-cérebro pode influenciar os mecanismos fisiopatológicos envolvidos no risco e progressão da DP.1
Nas últimas duas décadas, o papel significativo dos
processos relacionados ao intestino no desenvolvimento e progressão
da DP tornou-se cada vez mais evidente.2,3 O envolvimento do sistema
gastrointestinal na DP foi reconhecido há mais de 200 anos por James
Parkinson em seu ensaio seminal sobre a 'Paralisia Agitante', onde
descreveu sintomas de constipação e um “estado desordenado do
estômago e intestinos”.4 Hoje, sabemos que a DP dá origem a uma
série de sintomas gastrointestinais e manifestações clínicas e
que estes podem preceder o início dos sintomas motores em
décadas.5,6 A constipação é uma característica prodrômica
clássica da DP e, além disso, parece predizer uma pior trajetória
da doença.6-8 A síndrome do intestino irritável é comum em
pacientes com DP e pessoas com doença inflamatória intestinal têm
um risco maior de DP do que aqueles sem.9 Vários fatores dietéticos
também foram associados ao aumento ou diminuição do risco de DP,
que, pelo menos em alguns casos, pode ser mediado pelo intestino.1
O
início e a gravidade da disfunção gastrointestinal variam entre os
pacientes, mas quase todos os pacientes com DP acabarão
experimentando pelo menos um sintoma gastrointestinal.5
Quase
todos os pacientes com DP acabarão experimentando pelo menos um
sintoma gastrointestinal.5
O eixo intestino-cérebro é uma
estrada para a comunicação intestino-cérebro
O interesse na
comunicação intestino-cérebro na DP foi despertado por estudos de
Braak e colegas em 2006, que demonstraram agregados de
alfa-sinucleína (uma marca patológica da DP) no cérebro e no
sistema nervoso entérico de indivíduos autopsiados com DP, levando
os autores a levantam a hipótese de que a DP pode começar no
intestino, possivelmente por meio de um patógeno capaz de passar
pelo revestimento epitelial gástrico.10
Desde então, estudos
em modelos animais demonstraram que a alfa-sinucleína pode de fato
se espalhar do trato gastrointestinal para o cérebro, bem como do
cérebro para o trato gastrointestinal através do nervo vago.11-13 A
comunicação bidirecional entre o sistema nervoso central e entérico
tem tornou-se conhecido como o eixo intestino-cérebro. Os principais
atores neste fluxo de informações foram propostos para incluir
inflamação intestinal (e sua associação com doenças
inflamatórias intestinais e o gene LRRK), hiperpermeabilidade
intestinal ('intestino permeável'), semeadura e propagação de
alfa-sinucleína no sistema nervoso entérico, e, mais recentemente,
o microbioma intestinal (Figura 1).1,11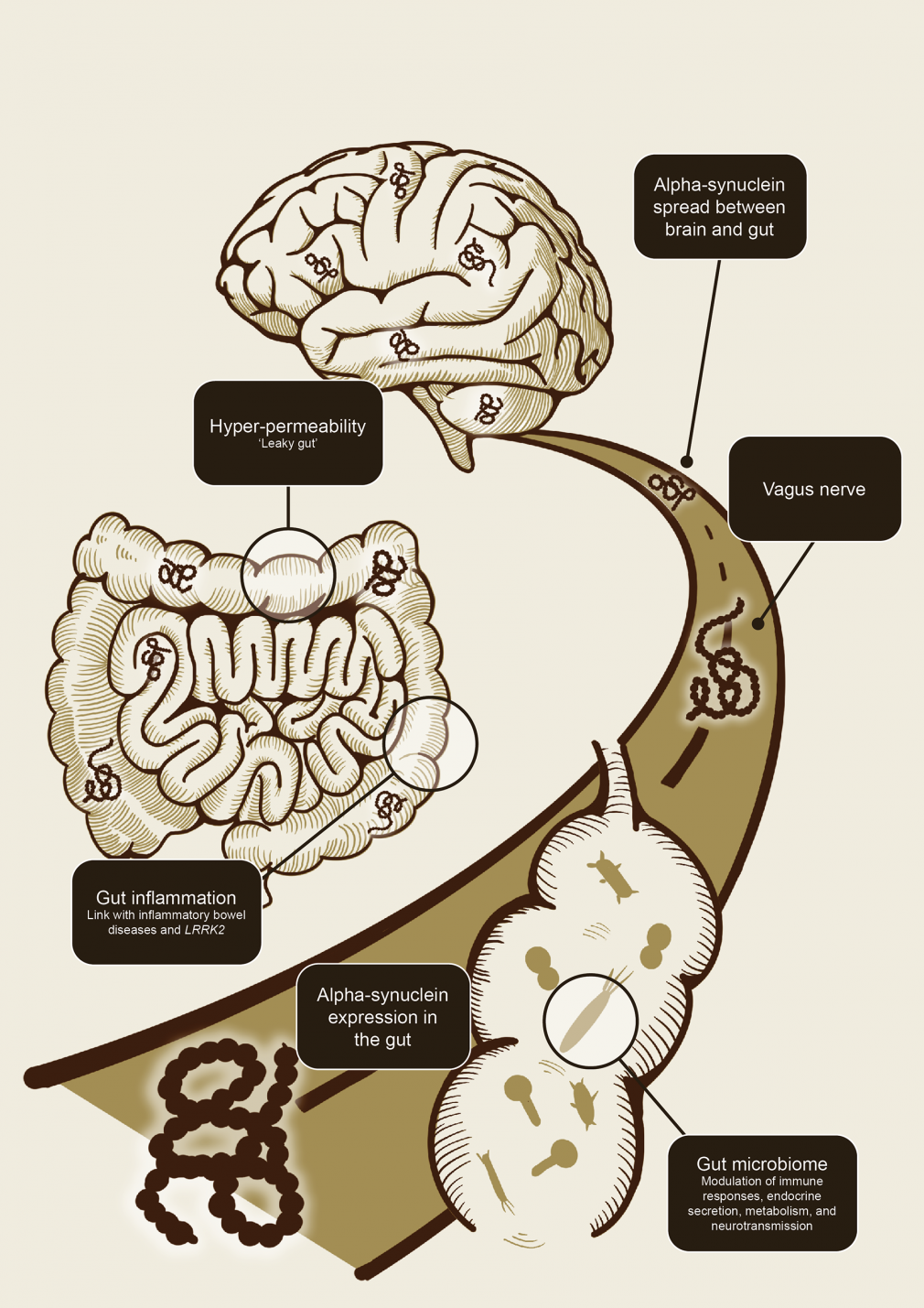 O eixo intestino-cérebro permite um fluxo bidirecional de informações entre o intestino e o cérebro.1,11-13
O eixo intestino-cérebro permite um fluxo bidirecional de informações entre o intestino e o cérebro.1,11-13
O eixo
microbioma-intestino-cérebro
Figura 1. Ilustração esquemática
de como o eixo intestino-cérebro pode contribuir para a disseminação
da patologia alfa-sinucleína (adaptado de Breen et al 2019). Foi
proposto que a inflamação intestinal e a hiperpermeabilidade e
alterações no microbioma intestinal estão associadas…
A
alfa-sinucleína, a inflamação intestinal e a permeabilidade
intestinal são elementos-chave no eixo intestino-cérebro
Tem
sido levantada a hipótese de que agregados mal dobrados de
alfa-sinucleína que se originam no sistema nervoso entérico viajam
para o cérebro via transferência transsináptica de célula a
célula semelhante a príon, embora o modo de transferência, bem
como a origem de alfa-sinucleína ainda não estão claros.11,14 Se a
DP começa no cérebro ou se começa no intestino, ou se há
fenótipos da doença tanto no intestino quanto no cérebro, é uma
área sob investigação ativa.6,15 -17
Se a DP começa no
cérebro ou se começa no intestino permanece
indeterminado.6,15-17
Em outros estudos, foi demonstrado que a
permeabilidade intestinal alterada ("intestino permeável")
e a inflamação intestinal também desempenham um papel na patologia
da DP em subconjuntos de pacientes.1,18,19
Curiosamente, alguns tipos de infecções (e subsequente inflamação da parede intestinal) mostraram induzir a expressão de alfa-sinucleína no trato gastrointestinal, o que levou à hipótese de que a expressão de alfa-sinucleína pode ser um mecanismo de defesa imune.11 Pro-sinucleína crônica. a atividade imune inflamatória é cada vez mais reconhecida como um elemento fundamental dos distúrbios neurogenerativos, incluindo a DP.19 O reconhecimento de uma conexão entre inflamação e DP foi reforçado por estudos observacionais que demonstram fortes ligações entre DP e doenças inflamatórias intestinais.18,20 Em estudos epidemiológicos e genéticos estudos, descobriu-se que pessoas com doença inflamatória intestinal tinham até 40% mais chances de desenvolver DP em comparação com aqueles sem doença inflamatória intestinal, com LRRK2 emergindo como um gene de suscetibilidade comum para ambas as doenças.18,20
O
microbioma intestinal e seu efeito na saúde do hospedeiro
Uma das
descobertas mais intrigantes relacionadas a esse campo é o papel do
microbioma intestinal na DP. Uma enorme comunidade microbiana
conhecida como microbiota reside sobre e dentro do corpo humano. Este
ecossistema invisível de micróbios está localizado em superfícies
externas e internas, como a pele, a cavidade oral e, particularmente,
dentro do trato gastrointestinal.21,22 O microbioma intestinal é
composto principalmente por bactérias, mas também inclui fungos,
vírus e protozoários , bem como seus genomas coletivos e o ambiente
que habitam.23 Esses micróbios agem como um vasto ecossistema
complexo no qual cada espécie tem o potencial de exercer diversos
efeitos sobre as espécies vizinhas.24 As estimativas mais recentes
sugerem que, para a pessoa média , células bacterianas e humanas
estão presentes em números aproximadamente iguais.25 Em uma pessoa
de referência de 70 kg, isso equivale a 38 trilhões de bactérias,
com uma massa total de cerca de 0,2 kg, a grande maioria das quais é
encontrada no intestino, particularmente no cólon .21,25
Os
microorganismos intestinais evoluíram ao longo de milhares de anos
para formar uma notável relação simbiótica com seus hospedeiros.
Em troca de alimentos por meio da ingestão dietética, os micróbios
fornecem uma variedade de funções imunológicas, digestivas e
nutricionais que são benéficas para o hospedeiro.26,27 O microbioma
e seu consórcio de genes podem ser considerados uma extensão do
repertório genético do hospedeiro para formam o que alguns agora
chamam de 'genótipo estendido'.28 Através da modificação de seu
fenótipo hospedeiro, isso pode significar que o microbioma ainda tem
o potencial de modificar a evolução humana.28
O microbioma
não é estático; é uma comunidade dinâmica que muda ao longo da
vida à medida que os indivíduos envelhecem.29,30 Diferenças
consideráveis na composição, abundância e função da microbiota
intestinal foram observadas entre indivíduos jovens e idosos em
estudos clínicos, muitas vezes demonstrando uma diminuição em
Bifidobacterium e Lactobacillus e um aumento de
Enterobacteriaceae.30,31 Essas alterações no microbioma estão
associadas a fatores como afinamento da mucosa, senescência
imunológica, mudanças na dieta e atividade física, medicamentos e
estado de saúde que ocorrem à medida que os indivíduos
envelhecem.1,32 Isso fenômeno levou à ideia de que mudanças
relacionadas à idade no microbioma intestinal podem estar associadas
à predisposição de pessoas idosas a certas doenças.31,33
Mudanças
no microbioma podem estar associadas à predisposição a certas
doenças.1,31,33
O microbioma pode ser alterado por vários
fatores, como dieta, genética, exposições ambientais, estado de
saúde e medicamentos.1 Os microrganismos intestinais também
interagem com o hospedeiro por meio de toxinas, subprodutos e
metabólitos secretados para modular as respostas imunes, secreção
endócrina, metabolismo , e neurotransmissão.34 As alterações do
microbioma podem resultar em uma mudança para uma superabundância
de bactérias associadas a um estado "não saudável" ou
patológico. Esse tipo de alteração no microbioma é geralmente
denominado disbiose e tem sido associado a uma variedade de doenças
metabólicas, gastrointestinais e neurológicas, incluindo
DP.1,20,30,31,35-37
Um papel para o microbioma intestinal na DP
Numerosos estudos examinaram o
microbioma intestinal de pacientes com DP e descobriram que ele
estava alterado em comparação com controles saudáveis.38-41 Em uma
recente análise metagenômica em larga escala do microbioma
intestinal de 490 pacientes com DP, mais de 30% dos espécies
microbianas, genes e vias testadas demonstraram alterações em
comparação com controles sem DP, retratando disbiose
generalizada.42 Tentativas de identificar os microrganismos precisos
associados à DP produziram resultados inconsistentes. No nível de
gênero, meta-análises mostraram que a abundância relativa de
bactérias anti-inflamatórias e produtoras de ácidos graxos de
cadeia curta (incluindo Blautia, Coprococcus, Roseburia, Lachnospira
e Faecalibacterium) é reduzida em pacientes com DP em comparação
com controles, enquanto os níveis de Lactobacillus, Bifidobacterium
e Akkermansia são criados. Patógenos oportunistas e bactérias
pró-inflamatórias (incluindo Alistipes, Escherichia, Bacteroides
Corynebacterium e Porphyromonas) também são enriquecidos em
pacientes com DP.34,36,43,44 Ainda não está claro se as alterações
observadas no microbioma de pacientes com DP são a ocorrência
inicial que contribui para o desenvolvimento da doença, ou se as
alterações surgem em resposta à patologia da DP; ambos são uma
possibilidade.19
Curiosamente, vários distúrbios intestinais
(incluindo infecções, disbiose, inflamação e dismotilidade), bem
como fatores dietéticos, mostraram influenciar a resposta à
medicação para DP.1 A terapêutica dirigida a micróbios está se
mostrando promissora no tratamento da DP. Estudos piloto de pequeno e
curto prazo mostraram melhorias nos sintomas motores e não motores,
como constipação e biodisponibilidade de levodopa, com intervenções
dietéticas e suplementação com probióticos/prebióticos.1 Outras
modalidades potencialmente úteis sendo testadas incluem transplante
de microbiota fecal e pequenas moléculas drogas, produtos biológicos
e metabólitos que atuam em alvos relacionados ao intestino.1
Estratégias direcionadas a patologias de DP (como agregação de
alfa-sinucleína) no sistema nervoso entérico também estão em
desenvolvimento e recentemente demonstraram sucesso em ensaios
clínicos envolvendo pacientes com DP.1,45 ,46 Em última análise,
espera-se que os avanços científicos neste campo se traduzam no uso
responsável de novas abordagens diagnósticas, prognósticas e
terapêuticas que melhorem a vida dos pacientes que vivem com DP.
Original em inglês, tradução Google, revisão Hugo. Fonte:
Neurotorium.
Nenhum comentário:
Postar um comentário