Estudo inédito
liderado por cientistas brasileiros identificou a relação
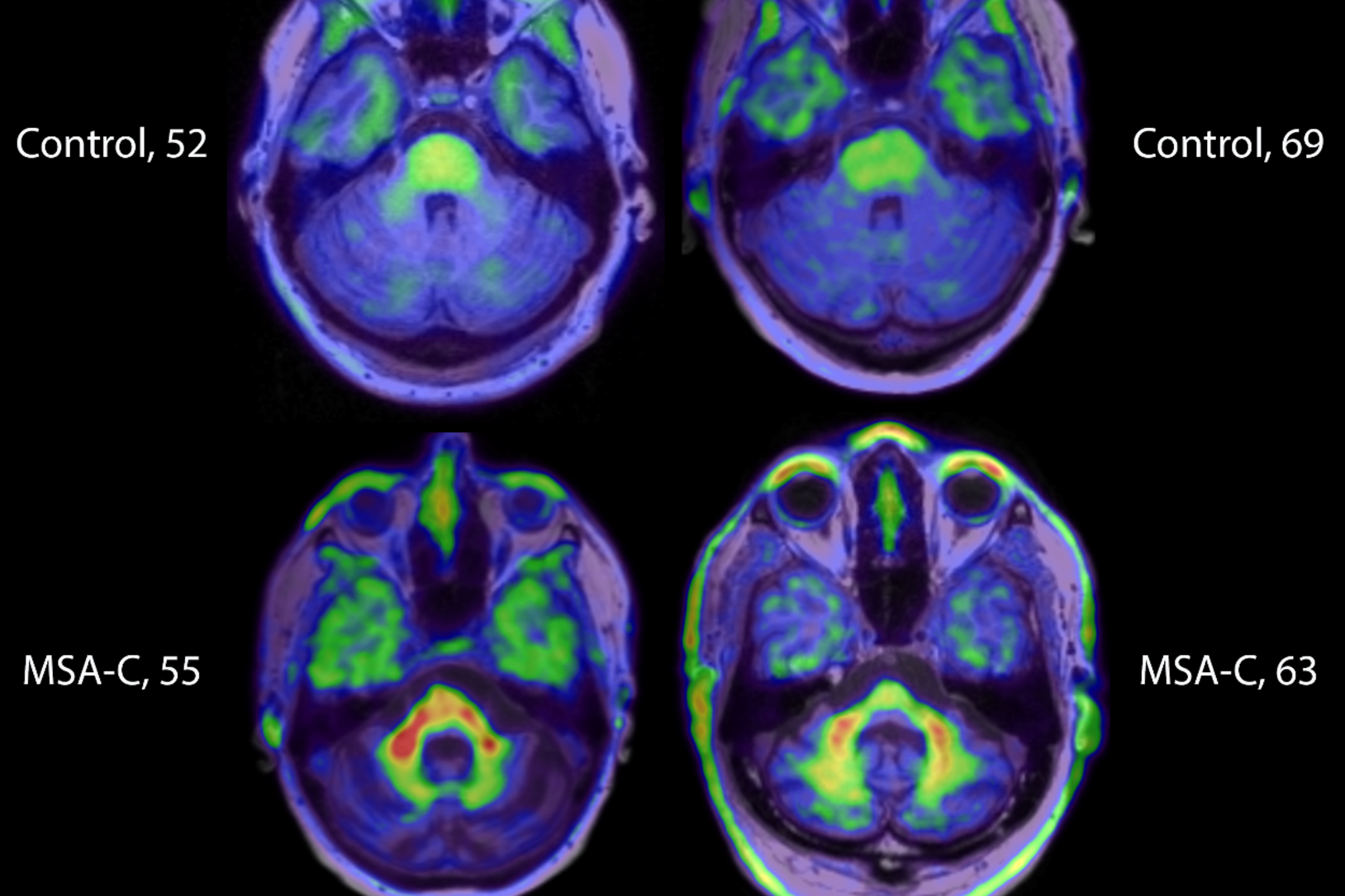
Doença de Parkinson - Foto: Pixabay
11/03/22 - Rugas e perda de
viço da pele podem revelar bem mais do que sinais de envelhecimento.
Um novo estudo sugere que seriam um indicador visível da presença
de depósitos anômalos de proteínas já associados a doenças
neurodegenerativas, em especial, o Parkinson.
Realizado por
cientistas brasileiros e publicado na revista científica
Neurobiology of Aging, o estudo abre mais do que janelas, mas um
portal de possibilidades para a compreensão do envelhecimento e de
formas para diagnosticar e tratar doenças neurodegenerativas, hoje
sem cura.
Ainda no campo da
hipótese, o trabalho lança bases para se imaginar, por exemplo, o
desenvolvimento de um creme para a pele que possa não apenas
retardar e amenizar os sinais de envelhecimento, mas também prevenir
ou tratar doenças que atacam o cérebro. Pois, os sinais na pele
antecederiam o avanço de distúrbios para o sistema nervoso central.
"A nova
pesquisa se soma a trabalhos internacionais recentes, que propõe uma
nova compreensão sobre o envelhecimento e as doenças
neurodegenerativas ligadas a ele, como o Parkinson e Alzheimer",
afirma o neurocientista Stevens Rehen, um dos autores do estudo e
pesquisador do Departamento de Genética do Instituto de Biologia da
Universidade Federal do Rio de Janeiro (UFRJ) e do Instituto D’Or
de Pesquisa e Ensino (IDOR).
A pele de qualquer
pessoa definha à medida que se envelhece, mas nem todo mundo terá
doenças neurodegenerativas na velhice. Porém, a ciência começa a
reunir pistas sobre os fatores que fazem a diferença entre doença e
envelhecimento saudável. Os agregados de determinadas proteínas
estão logo à frente na lista de culpados.
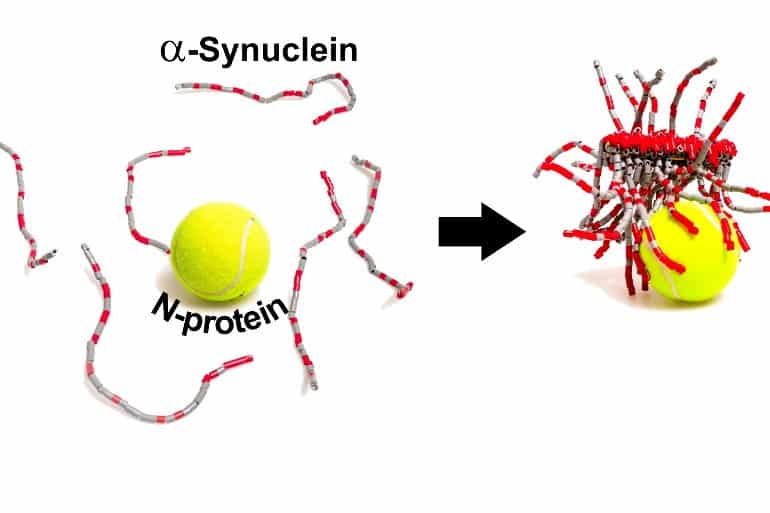
O estudo investigou
o que acontece com a pele quando exposta a agregados, ou seja,
depósitos, de uma proteína chamada alfa-sinucleína. Esses
agregados de alfa-sinucleína formam as fibras que matam os neurônios
produtores de dopamina de pacientes com Parkinson, levando a tremores
e problemas motores característicos da doença.
Já se sabia que
eles existem na pele de pessoas com Parkinson. Mas não como eles
afetam a pele de forma geral. Em condições normais, a
alfa-sinucleína é uma proteína importante para as sinapses, a
conversa entre os neurônios. Por motivos desconhecidos, ela pode
começar a se agregar. Nesse momento, ela se torna tóxica.
"O que fizemos
foi ‘desafiar’ um modelo de pele humana com agregados de
alfa-sinucleína e o que vimos nos impressionou", explica a
neurocientista Júlia Oliveira, pesquisadora do IDOR e primeira
autora do estudo, realizado em parceria com a UFRJ e a L’Oreal.
Eles viram a pele
envelhecer sob a lente do microscópio. Os cientistas usaram um
organoide, uma espécie de “minipele” desenvolvida em
laboratório, mas que tem a estrutura da epiderme (a camada
superficial) da pele humana. A minipele foi exposta aos agregados de
alfa-sinucleína e os pesquisadores observaram que os queratinócitos,
as principais células da epiderme humana, passaram a proliferar
menos.
Os queratinócitos
normalmente têm intensa proliferação, pois são eles que renovam e
mantém saudável a pele. Porém, uma vez expostos aos agregados,
eles começaram a degenerar. Isso porque os agregados deflagram uma
violenta resposta inflamatória do sistema de defesa do organismo.
O sistema
imunológico tenta, mas não consegue atacar os agregados. Eles são
muito grandes para serem engolidos por células de defesa
especializadas e resistentes a todas as enzimas que dissolvem
estruturas nocivas, explica Debora Foguel, também autora do estudo e
professora titular do Instituto de Bioquímica Médica da UFRJ. O
ataque imune fracassado acaba por levar à uma reação inflamatória
descontrolada. Com isso, a pele se torna mais fina e imperfeita.
"É a mesma
coisa que acontece no envelhecimento", observa Oliveira.
As mudanças na pele
podem ser um sinal de alerta antes que os agregados cheguem e se
estabeleçam no cérebro. Normalmente, os sinais clínicos das
doenças neurodegenerativas só se tornam perceptíveis quando o
estrago já está feito no cérebro, observa Foguel.
Como essas proteínas
anômalas se acumulam lentamente, à medida que envelhecemos,
detectá-las precocemente ainda na pele pode se tornar um instrumento
de diagnóstico poderoso para a medicina.
"Será que
intervenções na pele podem vir a aliviar a progressão de doenças
neurodegenerativas? É o que queremos investigar", salienta
Rehen.
O cérebro, que se
considerava a origem e o alvo dessas doenças, pode ser apenas o
derradeiro destino de um processo iniciado em outras partes do corpo,
como a pele e o intestino, onde esses agregados também já foram
encontrados em pacientes com Parkinson. Em vez de neurodegenerativas,
seriam doenças sistêmicas, isto é, que afetam numerosas partes do
corpo.
"Talvez não
existam propriamente doenças neurodegenerativas, mas sim doenças
sistêmicas provocadas pelo acúmulo de proteínas", diz Foguel.
Parkinson, Alzheimer
e uma série de outras doenças neurodegenerativas são causadas pelo
acúmulo de depósitos de proteínas. Elas se agregam e formam fibras
chamadas de amiloides. Pelo menos 30 proteínas podem formar fibras
amiloides associadas a doenças. Os exemplos mais conhecidos são
alfa-sinucleína (Parkinson), beta-amiloide (Alzheimer) e príon (mal
da vaca louca).
"Uma hipótese
interessante que nosso artigo levanta é se esses agregados de
alfa-sinucleína seriam capazes de serem transferidos da pele para
neurônios periféricos e de lá até o cérebro, contribuindo para o
avanço da doença. Um processo semelhante poderia ocorrer com os
agregados do Alzheimer", acrescenta Rehen.
A ciência ainda não
compreende a complexa linguagem de sinais bioquímicos entre a pele e
o cérebro. Mas já descobriu que, no ambiente controlado de
laboratório, é possível amenizar o avanço da degeneração
provocada pelos agregados ao controlar a inflamação.
Os pesquisadores
também querem identificar que motivos fazem proteínas se tornarem
nocivas. No caso da pele, a radiação ultravioleta é a candidata
mais óbvia por alterar o DNA e a expressão das proteínas, mas não
está sozinha.
"Os agregados
vão se juntando ao longo da vida. Obesidade, que é inflamatória;
infecções virais; dermatites, há numerosas condições que podem
influenciar", afirma a neurocientista Marília Zaluar Guimarães,
do IDOR e do Instituto de Ciências Biomédicas da UFRJ, que também
participou do estudo.
"Os agregados
aceleram a degeneração da pele, não apenas de quem tem Parkinson.
Não se sabe o quão frequentes são. Porém, podemos vislumbrar
formas de cuidar melhor da pele ao tratá-los", enfatiza Júlia
Oliveira. Fonte: Folha de Pernambuco.